Avant le DCCT
Jusqu’à la découverte de l’insuline par Banting en 1921, le diabète insulino- dépendant était une maladie rapidement mortelle, malgré les multiples tentatives de traitement, notamment diététique. Les injections d’insuline ont permis des survies prolongées, et le diabète est devenu une maladie chronique, avec un risque de complications vasculaires qui n’avaient jusqu’alors été décrites, au xixe siècle, que chez les diabétiques non insulino-dépendants.
Il était logique d’espérer que la normalisation au long cours des glycémies permette d’éviter ces complications. Les travaux de cliniciens précurseurs étaient en faveur de cette hypothèse, par exemple ceux de Jean Pirart qui avait montré dans les années 1950 que ses patients dont les glycémies étaient les moins élevées, dosées à l’époque à l’aide de comprimés réactifs, avaient moins de complications, ou ceux de l’équipe de l’Hôtel-Dieu à Paris dans les années 1970, avec l’apparition de moins de microanévrismes rétiniens sous multi-injections quotidiennes d’insuline.
Mais ce n’était pas certain, et les arguments qui pouvaient plaider contre le contrôle glycémique restent intéressants à considérer maintenant que la réponse est connue : avant tout, les hypoglycémies, qui se sont confirmées et restent une limite importante ; ensuite les aggravations initiales (early worsening) de rétinopathies avec la baisse des glycémies, notamment sous pompe à insuline, confirmées dans les premières années du DCCT, mais heureusement transitoires dans la majorité des cas. Au-delà de ces risques, la faisabilité même d’un contrôle glycémique durable n’était pas évidente, notamment chez certains patients, par exemple les adolescents, dont la prise en charge continue de poser des difficultés importantes. En fait, la réussite du DCCT n’était pas assurée, plusieurs essais randomisés testant le contrôle glycémique avaient échoué du fait d’une durée de suivi insuffisante. Les progrès de la pharmacologie et le développement d’insulines d’action de plus en plus prolongée, malgré leur intérêt, pouvaient enfin engager sur la fausse piste d’une pseudo-amélioration de la condition des patients par la réduction du nombre des injections, depuis clairement réfutée.
Au début des années 1980, les avancées de la médecine fondée sur les preuves et les progrès techniques en diabétologie : multi-injections d’insuline, pompes externes, mais aussi autosurveillance glycémique et dosage de l’hémoglobine glyquée (HbA1c), ont permis de concevoir un essai am- bitieux, ample et prolongé, pour trancher la question de l’intérêt du contrôle glycémique pour prévenir ou ralentir les complications vasculaires du diabète de type 1 : le DCCT.
Il était logique d’espérer que la normalisation au long cours des glycémies permette d’éviter ces complications. Les travaux de cliniciens précurseurs étaient en faveur de cette hypothèse, par exemple ceux de Jean Pirart qui avait montré dans les années 1950 que ses patients dont les glycémies étaient les moins élevées, dosées à l’époque à l’aide de comprimés réactifs, avaient moins de complications, ou ceux de l’équipe de l’Hôtel-Dieu à Paris dans les années 1970, avec l’apparition de moins de microanévrismes rétiniens sous multi-injections quotidiennes d’insuline.
Mais ce n’était pas certain, et les arguments qui pouvaient plaider contre le contrôle glycémique restent intéressants à considérer maintenant que la réponse est connue : avant tout, les hypoglycémies, qui se sont confirmées et restent une limite importante ; ensuite les aggravations initiales (early worsening) de rétinopathies avec la baisse des glycémies, notamment sous pompe à insuline, confirmées dans les premières années du DCCT, mais heureusement transitoires dans la majorité des cas. Au-delà de ces risques, la faisabilité même d’un contrôle glycémique durable n’était pas évidente, notamment chez certains patients, par exemple les adolescents, dont la prise en charge continue de poser des difficultés importantes. En fait, la réussite du DCCT n’était pas assurée, plusieurs essais randomisés testant le contrôle glycémique avaient échoué du fait d’une durée de suivi insuffisante. Les progrès de la pharmacologie et le développement d’insulines d’action de plus en plus prolongée, malgré leur intérêt, pouvaient enfin engager sur la fausse piste d’une pseudo-amélioration de la condition des patients par la réduction du nombre des injections, depuis clairement réfutée.
Au début des années 1980, les avancées de la médecine fondée sur les preuves et les progrès techniques en diabétologie : multi-injections d’insuline, pompes externes, mais aussi autosurveillance glycémique et dosage de l’hémoglobine glyquée (HbA1c), ont permis de concevoir un essai am- bitieux, ample et prolongé, pour trancher la question de l’intérêt du contrôle glycémique pour prévenir ou ralentir les complications vasculaires du diabète de type 1 : le DCCT.
L’essai DCCT
À partir de 1983, 1 441 jeunes patients d’âge compris entre 13 et 39 ans atteints de diabète de type 1 ont été inclus dans 21 centres nord-américains. Ils étaient également répartis dans une cohorte de prévention primaire des complications (N = 726 : diabète depuis 1 à 5 ans, absence de rétinopathie ou de microalbuminurie pathologique) et une cohorte de prévention secondaire (N = 715 : diabète depuis 1 à 15 ans, rétinopathie minime et microalbuminurie inférieure à 200 mg/24 h). Ils ont été randomisés dans deux bras de traitement : traitement intensif avec au moins 3 injections quotidiennes d’insuline (et souvent une pompe externe), adaptées en fonction d’une autosurveillance glycémique rapprochée (4 surveillances par jour au moins) qui visait à normaliser l’HbA1c à 6 %, et traitement conventionnel avec 1 à 2 injections et une surveillance glycémique capillaire (ou urinaire) par jour.
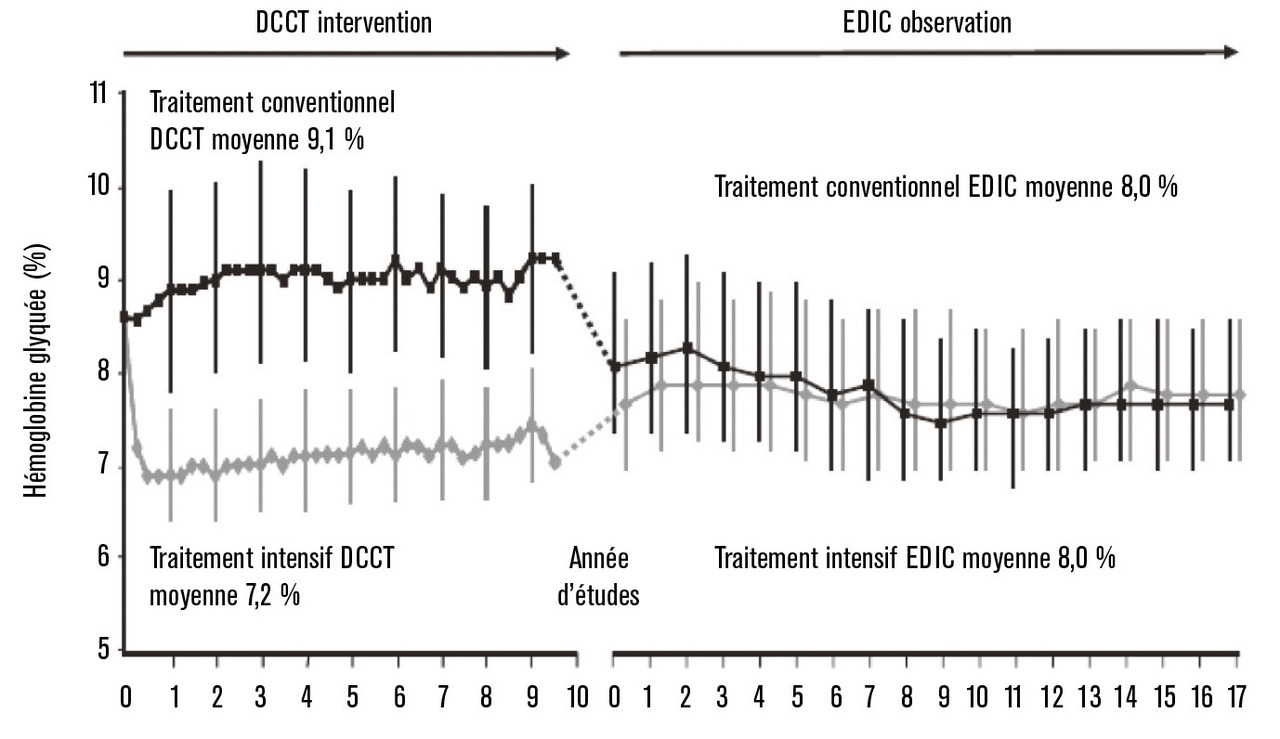
Le succès de l’intervention intensive a conduit le comité de surveillance de l’essai à l’interrompre après 6,5 ans de suivi, un an avant la date prévue, pour en publier les résultats en 1993.1 Comme illustré sur la figure 1, les patients du bras intensif ont eu une amélioration significative et soutenue de l'HbA1c, à 7 %, alors que les patients du bras conventionnel sont restés à 9 %. Les hypoglycémies sévères ont été trois fois plus fréquentes dans le bras intensif, et moins de 5 % des patients ont pu atteindre durablement l’objectif d’une HbA1c normale à 6 %. Surtout, les complications microvasculaires ont été deux fois moins fréquentes dans le bras intensif. Pour les rétinopathies, moins d’apparitions (-76 %), moins d’aggravations (-54 %), moins de formes graves, prolifératives ou préprolifératives, menaçant la vision (-47 %). Les micro- et macroprotéinuries et les neuropathies, quelle que soit leur définition (clinique, électrophysiologique, autonome), ont aussi été deux fois moins fréquentes. Depuis 1993, l’objectif de 7 % pour l’HbAc dans le diabète de type 1 est devenu consensuel.
Le succès de l’intervention intensive a conduit le comité de surveillance de l’essai à l’interrompre après 6,5 ans de suivi, un an avant la date prévue, pour en publier les résultats en 1993.1 Comme illustré sur la figure 1, les patients du bras intensif ont eu une amélioration significative et soutenue de l'HbA1c, à 7 %, alors que les patients du bras conventionnel sont restés à 9 %. Les hypoglycémies sévères ont été trois fois plus fréquentes dans le bras intensif, et moins de 5 % des patients ont pu atteindre durablement l’objectif d’une HbA1c normale à 6 %. Surtout, les complications microvasculaires ont été deux fois moins fréquentes dans le bras intensif. Pour les rétinopathies, moins d’apparitions (-76 %), moins d’aggravations (-54 %), moins de formes graves, prolifératives ou préprolifératives, menaçant la vision (-47 %). Les micro- et macroprotéinuries et les neuropathies, quelle que soit leur définition (clinique, électrophysiologique, autonome), ont aussi été deux fois moins fréquentes. Depuis 1993, l’objectif de 7 % pour l’HbAc dans le diabète de type 1 est devenu consensuel.
La suite : DCCT-EDIC
Il n’aurait pas été acceptable sur le plan éthique de prolonger l’essai, et après 1993 les HbA1c des bras intensif et conventionnel se sont rejointes à 8 %. Mais la ténacité des investigateurs et des patients, dont 99 % se maintenaient dans l’étude après 6,5 ans, a permis de poursuivre le suivi au long cours de la cohorte initiale dans l’étude Diabetes Control and Complications Trial-Epidemiology of Diabetes Intervention and Complications (DCCT- EDIC) : 85 % des patients restaient suivis 30 ans après les premières inclusions.2 Ce suivi a apporté des informations importantes, notamment au cours des dernières années :
– la réduction du risque de complications vasculaires ne concerne pas que la microangiopathie, mais aussi la macroangiopathie : -30 % à 30 ans ;3
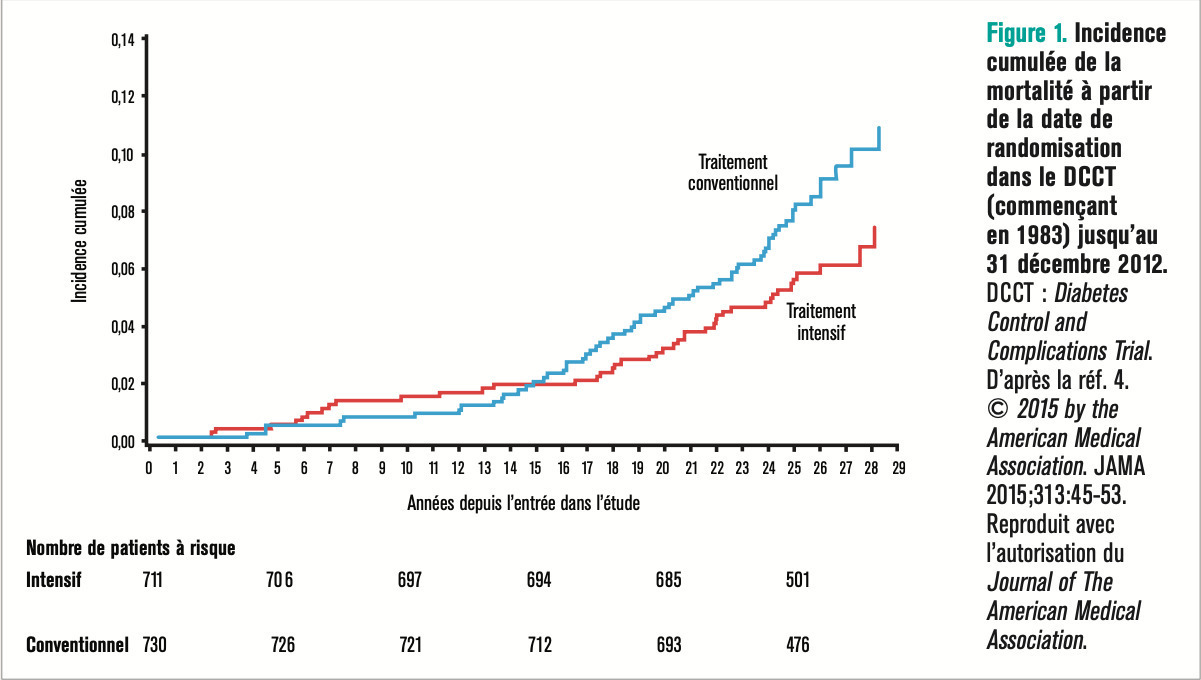
– la mortalité (107 décès dont 24 d’origine cardiovasculaire, 21 cancers, 19 complications aiguës du diabète, 18 accidents ou suicides) est réduite de -33 % dans le bras intensif après 27 ans de suivi.4 Cette différence est significative mais modeste : 64 décès après traitement conventionnel contre 43 après traitement intensif. On notera que les décès ont été légèrement plus fréquents dans le groupe intensif pendant la durée de l’essai, et que les courbes de mortalité ne se sont croisées qu’après 15 années de suivi, comme illustré sur la figure 2 ;
– bien que les valeurs des HbA1c des patients des deux bras initiaux soient similaires depuis la fin de la période d’intervention, la réduction du risque d’atteinte microangiopathique ne s’est pas estompée, au contraire elle a atteint -80 % après quelques années.5 Cet effet a fait émerger le concept de mémoire métabolique, dont la validité a depuis aussi été vérifiée dans le diabète de type 2 par le suivi post-essai de l’United Kingdom Prospective Diabetes Study (UKPDS). Cette mémoire métabolique de l’hyperglycémie a deux visages en pratique : le bon est que le contrôle glycémique est un travail utile pour le présent mais aussi pour l’avenir des patients ; le mauvais est que ce qui a été perdu pendant des années de mauvais contrôle glycémique ne sera pas regagné ensuite.
Après plus de 35 années, le DCCT- EDIC reste une source irremplaçable d’informations nouvelles, dont les auteurs publient encore en 2017, chaque mois en moyenne, de nouveaux résultats originaux. Tous les patients ayant un diabète de type 1 n’ont pas l’optimisme et la disponibilité qu’implique la participation à un essai randomisé dont les bras avaient des traitements aussi différents, ni le niveau d’acceptation reflété par le maintien d’un suivi régulier pendant 30 ans, et même dans le DCCT l’HbA1c à 7 % n’a pas été maintenue après la phase initiale d’intervention. Mais l’exploit accompli par les patients et les médecins qui ont pu conduire cette étude est extraordinaire. V
– la réduction du risque de complications vasculaires ne concerne pas que la microangiopathie, mais aussi la macroangiopathie : -30 % à 30 ans ;3
– la mortalité (107 décès dont 24 d’origine cardiovasculaire, 21 cancers, 19 complications aiguës du diabète, 18 accidents ou suicides) est réduite de -33 % dans le bras intensif après 27 ans de suivi.4 Cette différence est significative mais modeste : 64 décès après traitement conventionnel contre 43 après traitement intensif. On notera que les décès ont été légèrement plus fréquents dans le groupe intensif pendant la durée de l’essai, et que les courbes de mortalité ne se sont croisées qu’après 15 années de suivi, comme illustré sur la figure 2 ;
– bien que les valeurs des HbA1c des patients des deux bras initiaux soient similaires depuis la fin de la période d’intervention, la réduction du risque d’atteinte microangiopathique ne s’est pas estompée, au contraire elle a atteint -80 % après quelques années.5 Cet effet a fait émerger le concept de mémoire métabolique, dont la validité a depuis aussi été vérifiée dans le diabète de type 2 par le suivi post-essai de l’United Kingdom Prospective Diabetes Study (UKPDS). Cette mémoire métabolique de l’hyperglycémie a deux visages en pratique : le bon est que le contrôle glycémique est un travail utile pour le présent mais aussi pour l’avenir des patients ; le mauvais est que ce qui a été perdu pendant des années de mauvais contrôle glycémique ne sera pas regagné ensuite.
Références
1. The Diabetes Control and Complications Trial research group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. New Engl J Med 1993;329:977-86.
2. Nathan DM, for the DCCT/EDIC research group. The Diabetes Control and Complications Trial and Epidemiology of Diabetes Intervention and Complications at 30 years: overview. Diabetes Care 2014;37:9-16.
3. The Diabetes Control and Complications Trial and Epidemiology of Diabetes Intervention and Complications research group. Intensive diabetes treatment and cardiovascular outcomes in type 1 diabetes: the DCCT/EDIC study 30-year follow-up. DiabetesCare 2016;39:686-93.
4. Writing group for the DCCT/EDIC research group, Orchard TJ, Nathan DM, Zinman B, et al. Association between 7 years of intensive treatment of type 1 diabetes and long-term mortality. JAMA 2015;313:45-53.
5. The Diabetes Control and Complications Trial and Epidemiology of Diabetes Intervention and Complications research group. Retinopathy and nephropathy in patients with type 1 diabetes four years after a trial of intensive therapy. New Engl J Med 2000;342:381-9.
2. Nathan DM, for the DCCT/EDIC research group. The Diabetes Control and Complications Trial and Epidemiology of Diabetes Intervention and Complications at 30 years: overview. Diabetes Care 2014;37:9-16.
3. The Diabetes Control and Complications Trial and Epidemiology of Diabetes Intervention and Complications research group. Intensive diabetes treatment and cardiovascular outcomes in type 1 diabetes: the DCCT/EDIC study 30-year follow-up. DiabetesCare 2016;39:686-93.
4. Writing group for the DCCT/EDIC research group, Orchard TJ, Nathan DM, Zinman B, et al. Association between 7 years of intensive treatment of type 1 diabetes and long-term mortality. JAMA 2015;313:45-53.
5. The Diabetes Control and Complications Trial and Epidemiology of Diabetes Intervention and Complications research group. Retinopathy and nephropathy in patients with type 1 diabetes four years after a trial of intensive therapy. New Engl J Med 2000;342:381-9.