Les tumeurs des glandes salivaires représentent un groupe hétérogène de lésions, bénignes ou malignes, pouvant atteindre toutes les glandes. Elles regroupent un grand nombre d’histologies différentes : plus de 20 types de tumeurs malignes et plus de 10 types de tumeurs épithéliales bénignes sont recensées dans la dernière classification de l’Organisation mondiale de la santé (OMS).1 Ces différentes tumeurs, plus ou moins fréquentes, ont une évolution clinique et un pronostic différent ; il est donc important d’obtenir un diagnostic précis pour permettre une prise en charge thérapeutique adaptée.
Tumeurs rares pouvant atteindre de nombreux sites anatomiques
Si toutes les glandes peuvent être touchées, la parotide est la glande salivaire le plus souvent atteinte. Elle est dix fois plus concernée que la glande sous-mandibulaire et que les glandes salivaires accessoires et cent fois plus que la glande sublinguale.2 Du fait de la répartition anatomique des glandes salivaires accessoires, de nombreux sites anatomiques peuvent être atteints, tels que la cavité orale, l’oropharynx, les cavités rhino-sinusiennes, le larynx et la trachée. Ces tumeurs peuvent survenir à tous les âges de la vie, avec cependant un pic d’incidence entre 40 et 70 ans, et moins de 5 % des tumeurs des glandes salivaires sont observées chez l’enfant.3
Environ deux tiers des tumeurs des glandes salivaires sont bénignes,3 au premier rang desquelles se situent l’adénome pléomorphe et le cystadénolymphome (aussi appelé tumeur de Warthin). Les tumeurs bénignes représentent 80 % des tumeurs parotidiennes mais 50 % des tumeurs de la glande sous-mandibulaire, 20 % de celles des glandes salivaires accessoires et 5 % de celles des glandes sublinguales (tableau 1 ).2
Avec une incidence estimée à 0,6 pour 100 000 personnes par an en France,4 les cancers des glandes salivaires font partie des tumeurs rares.
Les formes histologiques les plus fréquentes sont le carcinome mucoépidermoïde, le carcinome adénoïde kystique, le carcinome à cellules acineuses, les adénocarcinomes et le carcinome ex-adénome pléomorphe. Cette distribution varie selon la glande concernée (tableau 1 ).
En France, la survie globale des patients atteints d’un cancer des glandes salivaires est de 60 % à cinq ans chez l’homme et de 68 % chez la femme.4
Environ deux tiers des tumeurs des glandes salivaires sont bénignes,3 au premier rang desquelles se situent l’adénome pléomorphe et le cystadénolymphome (aussi appelé tumeur de Warthin). Les tumeurs bénignes représentent 80 % des tumeurs parotidiennes mais 50 % des tumeurs de la glande sous-mandibulaire, 20 % de celles des glandes salivaires accessoires et 5 % de celles des glandes sublinguales (
Avec une incidence estimée à 0,6 pour 100 000 personnes par an en France,4 les cancers des glandes salivaires font partie des tumeurs rares.
Les formes histologiques les plus fréquentes sont le carcinome mucoépidermoïde, le carcinome adénoïde kystique, le carcinome à cellules acineuses, les adénocarcinomes et le carcinome ex-adénome pléomorphe. Cette distribution varie selon la glande concernée (
En France, la survie globale des patients atteints d’un cancer des glandes salivaires est de 60 % à cinq ans chez l’homme et de 68 % chez la femme.4
Deux principales tumeurs bénignes
Adénome pléomorphe, à risque de transformation maligne
L’adénome pléomorphe est la tumeur des glandes salivaires la plus fréquente, représentant environ 70 % des tumeurs bénignes, et 45 % de toutes les tumeurs. Il touche le plus souvent la femme de 40 à 60 ans, mais peut survenir à tout âge. Sa localisation préférentielle est la parotide, suivie par la glande submandibulaire et les glandes salivaires accessoires.
Tumeur d’évolution lente mais progressive, elle présente un risque de transformation maligne de 5 à 15 %,5 augmentant avec le nombre d’années d’évolution et les récidives.
L’enjeu thérapeutique est fondé sur sa relation intime avec le nerf facial dans sa localisation parotidienne et sur le risque de récidive. La simple énucléation chirurgicale, qui était associée à un taux de récidive de 40 %, a été remplacée par une chirurgie d’exérèse au large de la tumeur, préservant les structures nobles telles que le nerf facial. Cette chirurgie constitue aujourd’hui le traitement de référence et permet de réduire le taux de récidive à 5 %.6
Tumeur d’évolution lente mais progressive, elle présente un risque de transformation maligne de 5 à 15 %,5 augmentant avec le nombre d’années d’évolution et les récidives.
L’enjeu thérapeutique est fondé sur sa relation intime avec le nerf facial dans sa localisation parotidienne et sur le risque de récidive. La simple énucléation chirurgicale, qui était associée à un taux de récidive de 40 %, a été remplacée par une chirurgie d’exérèse au large de la tumeur, préservant les structures nobles telles que le nerf facial. Cette chirurgie constitue aujourd’hui le traitement de référence et permet de réduire le taux de récidive à 5 %.6
Tumeur de Warthin : le tabagisme comme facteur de risque
La tumeur de Warthin, ou cystadénolymphome, représente environ 15 % des tumeurs bénignes. C’est une tumeur touchant principalement la glande parotide, le plus souvent au niveau du pôle inférieur de la glande. Elle concerne exclusivement les adultes, préférentiellement les hommes, et est très fortement liée au tabagisme.
Elle peut être multifocale, et même bilatérale dans 10 % des cas.7 Sa transformation maligne étant exceptionnelle,5 la chirurgie est indiquée en cas de doléance esthétique ou de doute diagnostique, et une surveillance active peut constituer une alternative dans les autres cas.7
Elle peut être multifocale, et même bilatérale dans 10 % des cas.7 Sa transformation maligne étant exceptionnelle,5 la chirurgie est indiquée en cas de doléance esthétique ou de doute diagnostique, et une surveillance active peut constituer une alternative dans les autres cas.7
Tumeurs malignes de pronostic variable
Carcinome mucoépidermoïde de pronostic variable selon le grade histologique
Il s’agit de la plus fréquente des tumeurs malignes, représentant 10 à 15 % des tumeurs des glandes salivaires et 30% des carcinomes. Son pronostic et son évolution varient en fonction du grade histologique, les tumeurs de bas grade (60 % des cas) ayant une survie globale à cinq ans de 90 % contre 67 % pour les tumeurs de haut grade.8
Carcinome adénoïde kystique à fort neurotropisme
Le carcinome adénoïde kystique représente environ 10 % des tumeurs des glandes salivaires. Il touche préférentiellement les femmes d’âge moyen. Sont atteintes le plus souvent les glandes salivaires accessoires et la parotide. Tumeur d’évolution lente, elle a cependant un fort neurotropisme.9 Le pronostic à long terme est mauvais (85 % de survie globale à cinq ans, mais 67 % à dix ans) avec une évolution imprévisible marquée par l’apparition parfois tardive de métastases ganglionnaires et viscérales.10
Carcinome à cellules acineuses : la glande parotide le plus souvent concernée
Le carcinome à cellules acineuses est une tumeur maligne de bas grade, touchant préférentiellement la femme, de tout âge avec un pic de fréquence autour de 60 ans. Il est localisé à la glande parotide dans 90 % des cas. Si la mortalité de ces tumeurs est faible (93 % de survie globale à cinq ans), la récidive n’est pas rare, et un petit nombre de cas évoluent avec une transformation de haut grade au pronostic plus sombre.11
Deux examens pour différencier tumeurs maligne et bénigne
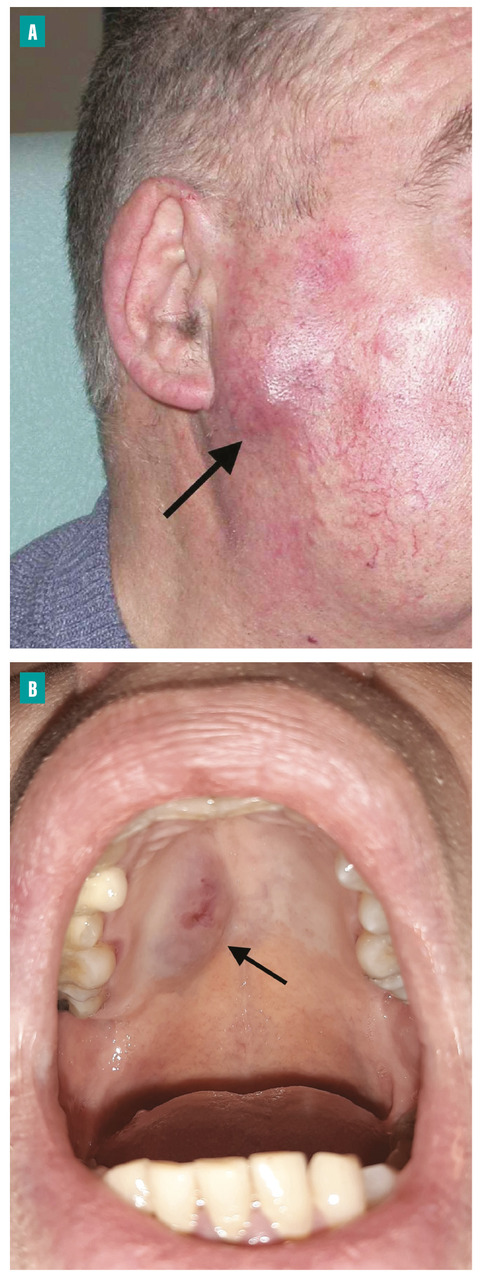
Les tumeurs des glandes salivaires sont le plus souvent découvertes sous la forme d’une tuméfaction isolée d’une des glandes salivaires (fig. 1 ).
L’examen clinique recherche une atteinte nerveuse (paralysie faciale et anesthésie du lobule de l’oreille dans les lésions parotidiennes, anesthésie linguale dans les lésions submandibulaires…), une adhérence tumorale aux tissus environnants (peau, tissus profonds) et des adénopathies cervicales dans les territoires de drainage, qui orientent vers une tumeur maligne.
L’échographie peut être utile en cas de doute diagnostique pour confirmer la localisation salivaire de la tumeur. Le reste du bilan s’attache ensuite à déterminer la bénignité ou la malignité de la lésion pour optimiser la prise en charge thérapeutique, en s’appuyant sur le couple imagerie par résonance magnétique (IRM) et cytoponction à l’aiguille fine.
L’examen clinique recherche une atteinte nerveuse (paralysie faciale et anesthésie du lobule de l’oreille dans les lésions parotidiennes, anesthésie linguale dans les lésions submandibulaires…), une adhérence tumorale aux tissus environnants (peau, tissus profonds) et des adénopathies cervicales dans les territoires de drainage, qui orientent vers une tumeur maligne.
L’échographie peut être utile en cas de doute diagnostique pour confirmer la localisation salivaire de la tumeur. Le reste du bilan s’attache ensuite à déterminer la bénignité ou la malignité de la lésion pour optimiser la prise en charge thérapeutique, en s’appuyant sur le couple imagerie par résonance magnétique (IRM) et cytoponction à l’aiguille fine.
IRM, examen de choix
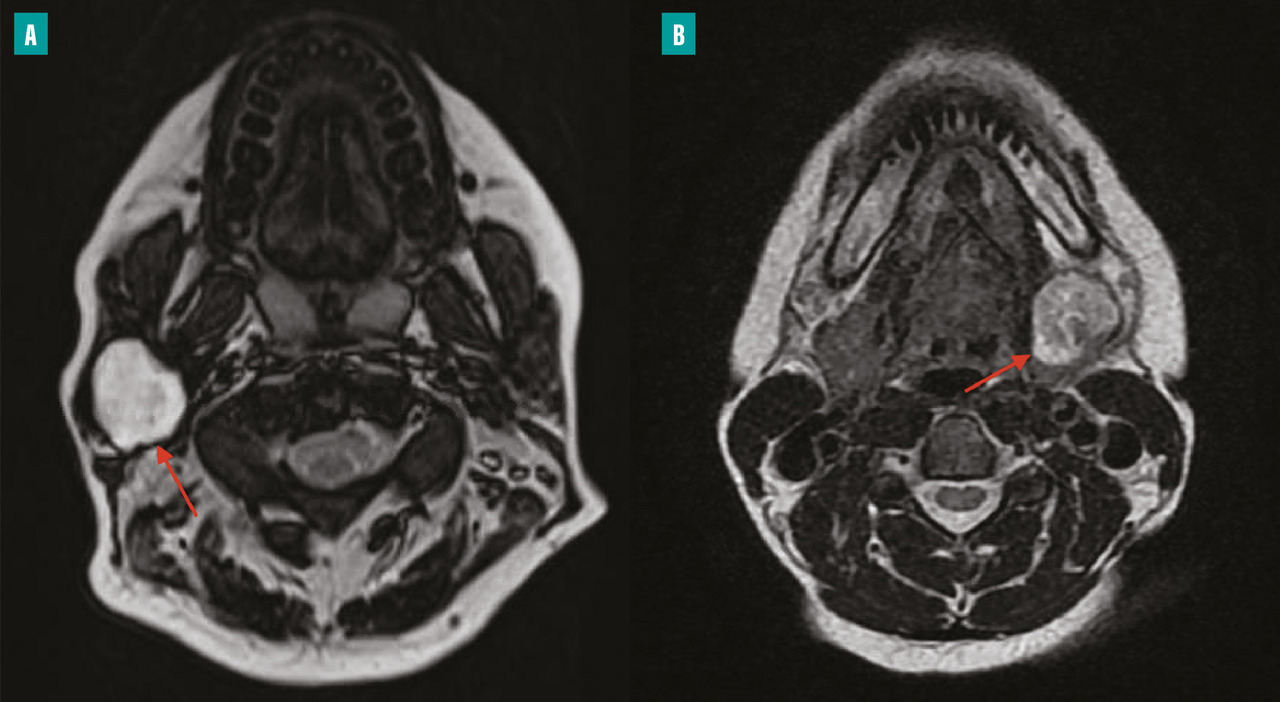
L’IRM constitue l’examen de choix dans l’exploration de la pathologie tumorale des glandes salivaires (fig. 2 ). Elle comprend des séquences T1, T2 et des séquences de diffusion et de perfusion après injection de gadolinium. Les séquences morphologiques recherchent des critères de malignité tels qu’une lésion mal limitée, envahissant les structures de proximité. Les séquences de perfusion permettent d’obtenir trois types de courbes : les courbes de type A sont évocatrices d’adénome pléomorphe ; les courbes de type B suggèrent une tumeur de Warthin ; les courbes de type C orientent vers une tumeur maligne. Les séquences de diffusion permettent aussi une orientation diagnostique par le calcul du ratio d’ADC (coefficient de diffusion apparent) : un rADC > 1,3 est en faveur d’un adénome pléomorphe ; un rADC < 1 est en faveur d’une tumeur maligne ou d’une tumeur de Warthin ; un rADC autour de 0,5 fait évoquer un lymphome.12 En couplant ces trois modalités, l’IRM permet de détecter une tumeur maligne avec une sensibilité de 86 % et une spécificité de 90 %.13
Cytoponction à l’aiguille fine en cas de doute
La cytoponction à l’aiguille fine est un examen sûr, efficace et peu coûteux. Il est donc nécessaire en cas de suspicion de malignité ou en cas de doute diagnostique à l’imagerie. Elle est idéalement réalisée sous contrôle échoguidé pour en augmenter la rentabilité diagnostique, après ou au minimum trois semaines avant l’IRM, pour ne pas créer d’artefacts. Depuis 2018, le résultat de l’analyse cytologique est donné selon le système de Milan, permettant de simplifier et d’harmoniser les comptes rendus, en stratifiant le risque de malignité. Cet examen permet de diagnostiquer une tumeur maligne avec une sensibilité de 78 % et une spécificité de 98 %.14
Combinaison des examens pour orienter le geste opératoire
La combinaison de ces deux examens diagnostiques permet d’orienter le clinicien vers la bénignité ou la malignité de la lésion, mais aussi parfois vers une histologie, ce qui a un intérêt pour programmer l’étendue de la résection parotidienne, un éventuel sacrifice nerveux, la réalisation ou non d’un curage cervical, et pour informer le patient au mieux avant une chirurgie. Le geste opératoire s’aide in fine de l’examen histologique extemporané de la pièce opératoire, qui peut apporter des arguments supplémentaires en faveur d’une histologie. En cas de tumeur suspecte de malignité, une tomodensitométrie (TDM) cervico-thoracique est réalisée pour le bilan d’extension régional et à distance. Le bilan d’imagerie permet ainsi le staging tumoral, qui utilise la classification TNM (tableau 2 ).
Traitement chirurgical en première intention
Le traitement des tumeurs des glandes salivaires est avant tout chirurgical lorsqu’il est réalisable : une chirurgie d’exérèse en marges saines est le traitement de référence. L’étendue de la résection dépend de l’histologie tumorale : si une chirurgie extracapsulaire est possible dans le cas de tumeurs bénignes, une exérèse totale de la glande est nécessaire pour une tumeur maligne. Le curage cervical est réalisé en cas d’envahissement ganglionnaire clinico-radiologique, ou en cas de tumeur à haut risque de métastases ganglionnaires (tumeurs de haut grade, tumeurs T3-T4). L’examen histologique de la pièce permet le diagnostic histologique de certitude. Du fait de la rareté de ces tumeurs, il peut nécessiter une relecture en centre expert (REFCORpath). Le grading histologique, l’état de la résection chirurgicale, les facteurs histologiques de mauvais pronostic sont des informations supplémentaires recueillies permettant la discussion d’un traitement complémentaire en réunion de concertation pluridisciplinaire (RCP). Des RCP nationales sont organisées par le Réseau d’expertise français sur les cancers ORL rares (REFCOR) pour optimiser la prise en charge de ces pathologies rares et complexes. La radiothérapie postopératoire est discutée en cas de présence d’un ou de plusieurs facteurs histopronostiques péjoratifs (stade T3-T4, N+, marges de résection limites ou envahies, haut grade histologique…).15
Références
1. Skálová A, Hyrcza MD, Leivo I. Update from the 5th edition of the World Health Organization Classification of head and neck tumors: Salivary glands. Head Neck Pathol 2022;16(1):40‑53.
2. Bradley PJ. Frequency and histopathology by site, major pathologies, symptoms and signs of salivary gland neoplasms. Adv Otorhinolaryngol 2016;78:9‑16.
3. Alsanie I, Rajab S, Cottom H, Adegun O, Agarwal R, Jay A, et al. Distribution and frequency of salivary gland tumours: An international multicenter study. Head Neck Pathol 2022;16(4):1043‑54.
4. Defossez G, Le Guyader-Peyrou S, Uhry Z, Grosclaude P, Colonna M, Dantony E, et al. Estimations nationales de l’incidence et de la mortalité par cancer en France métropolitaine entre 1990 et 2018. INCa; 2019 juill p. 372.
5. Hellquist H, Paiva-Correia A, Vander Poorten V, Quer M, Hernandez-Prera JC, Andreasen S, et al. Analysis of the clinical relevance of histological classification of benign epithelial salivary gland tumours. Adv Ther 2019;36(8):1950‑74.
6. Leonetti JP, Marzo SJ, Petruzzelli GJ, Herr B. Recurrent pleomorphic adenoma of the parotid gland. Otolaryngol Head Neck Surg 2005;133(3):319‑22.
7. Quer M, Hernandez-Prera JC, Silver CE, Casasayas M, Simo R, Vander Poorten V, et al. Current trends and controversies in the management of Warthin tumor of the parotid gland. Diagnostics (Basel) 2021;11(8):1467.
8. Dahan LS, Giorgi R, Vergez S, Le Taillandier de Gabory L, Costes-Martineau V, Herman P, et al. Mucoepidermoid carcinoma of salivary glands: A French Network of Rare Head and Neck Tumors (REFCOR) prospective study of 292 cases. Eur J Surg Oncol 2021;47(6):1376-83.
9. Coca-Pelaz A, Rodrigo JP, Bradley PJ, Vander Poorten V, Triantafyllou A, Hunt JL, et al. Adenoid cystic carcinoma of the head and neck-An update. Oral Oncol 2015;51(7):652‑61.
10. Atallah S, Casiraghi O, Fakhry N, Wassef M, Uro-Coste E, Espitalier F, et al. A prospective multicentre REFCOR study of 470 cases of head and neck adenoid cystic carcinoma: Epidemiology and prognostic factors. Eur J Cancer 2020;130:241-9.
11. Chatelet F, Ferrand FR, Atallah S, Thariat J, Mouawad F, Fakhry N, et al. Survival outcomes, prognostic factors, and effect of adjuvant radiotherapy and prophylactic neck dissection in salivary acinic cell carcinoma: A prospective multicenter REFCOR study of 187 patients. European Journal of Cancer 2023;185:11-27.
12. Gökçe E. Multiparametric magnetic resonance imaging for the diagnosis and differential diagnosis of parotid gland tumors. J Magn Reson Imaging 2020;52(1):11-32.
13. Liang YY, Xu F, Guo Y, Wang J. Diagnostic accuracy of magnetic resonance imaging techniques for parotid tumors, a systematic review and meta-analysis. Clin Imaging 2018;52:36‑43.
14. Liu CC, Jethwa AR, Khariwala SS, Johnson J, Shin JJ. Sensitivity, specificity, and posttest probability of parotid fine-needle aspiration: A systematic review and meta-analysis. Otolaryngol Head Neck Surg 2016;154(1):9‑23.
15. van Herpen C, Vander Poorten V, Skalova A, Terhaard C, Maroldi R, van Engen A, et al. Salivary gland cancer: ESMO-European Reference Network on Rare Adult Solid Cancers (EURACAN) Clinical Practice Guideline for diagnosis, treatment and follow-up. ESMO Open. 2022;7(6):100602.
2. Bradley PJ. Frequency and histopathology by site, major pathologies, symptoms and signs of salivary gland neoplasms. Adv Otorhinolaryngol 2016;78:9‑16.
3. Alsanie I, Rajab S, Cottom H, Adegun O, Agarwal R, Jay A, et al. Distribution and frequency of salivary gland tumours: An international multicenter study. Head Neck Pathol 2022;16(4):1043‑54.
4. Defossez G, Le Guyader-Peyrou S, Uhry Z, Grosclaude P, Colonna M, Dantony E, et al. Estimations nationales de l’incidence et de la mortalité par cancer en France métropolitaine entre 1990 et 2018. INCa; 2019 juill p. 372.
5. Hellquist H, Paiva-Correia A, Vander Poorten V, Quer M, Hernandez-Prera JC, Andreasen S, et al. Analysis of the clinical relevance of histological classification of benign epithelial salivary gland tumours. Adv Ther 2019;36(8):1950‑74.
6. Leonetti JP, Marzo SJ, Petruzzelli GJ, Herr B. Recurrent pleomorphic adenoma of the parotid gland. Otolaryngol Head Neck Surg 2005;133(3):319‑22.
7. Quer M, Hernandez-Prera JC, Silver CE, Casasayas M, Simo R, Vander Poorten V, et al. Current trends and controversies in the management of Warthin tumor of the parotid gland. Diagnostics (Basel) 2021;11(8):1467.
8. Dahan LS, Giorgi R, Vergez S, Le Taillandier de Gabory L, Costes-Martineau V, Herman P, et al. Mucoepidermoid carcinoma of salivary glands: A French Network of Rare Head and Neck Tumors (REFCOR) prospective study of 292 cases. Eur J Surg Oncol 2021;47(6):1376-83.
9. Coca-Pelaz A, Rodrigo JP, Bradley PJ, Vander Poorten V, Triantafyllou A, Hunt JL, et al. Adenoid cystic carcinoma of the head and neck-An update. Oral Oncol 2015;51(7):652‑61.
10. Atallah S, Casiraghi O, Fakhry N, Wassef M, Uro-Coste E, Espitalier F, et al. A prospective multicentre REFCOR study of 470 cases of head and neck adenoid cystic carcinoma: Epidemiology and prognostic factors. Eur J Cancer 2020;130:241-9.
11. Chatelet F, Ferrand FR, Atallah S, Thariat J, Mouawad F, Fakhry N, et al. Survival outcomes, prognostic factors, and effect of adjuvant radiotherapy and prophylactic neck dissection in salivary acinic cell carcinoma: A prospective multicenter REFCOR study of 187 patients. European Journal of Cancer 2023;185:11-27.
12. Gökçe E. Multiparametric magnetic resonance imaging for the diagnosis and differential diagnosis of parotid gland tumors. J Magn Reson Imaging 2020;52(1):11-32.
13. Liang YY, Xu F, Guo Y, Wang J. Diagnostic accuracy of magnetic resonance imaging techniques for parotid tumors, a systematic review and meta-analysis. Clin Imaging 2018;52:36‑43.
14. Liu CC, Jethwa AR, Khariwala SS, Johnson J, Shin JJ. Sensitivity, specificity, and posttest probability of parotid fine-needle aspiration: A systematic review and meta-analysis. Otolaryngol Head Neck Surg 2016;154(1):9‑23.
15. van Herpen C, Vander Poorten V, Skalova A, Terhaard C, Maroldi R, van Engen A, et al. Salivary gland cancer: ESMO-European Reference Network on Rare Adult Solid Cancers (EURACAN) Clinical Practice Guideline for diagnosis, treatment and follow-up. ESMO Open. 2022;7(6):100602.