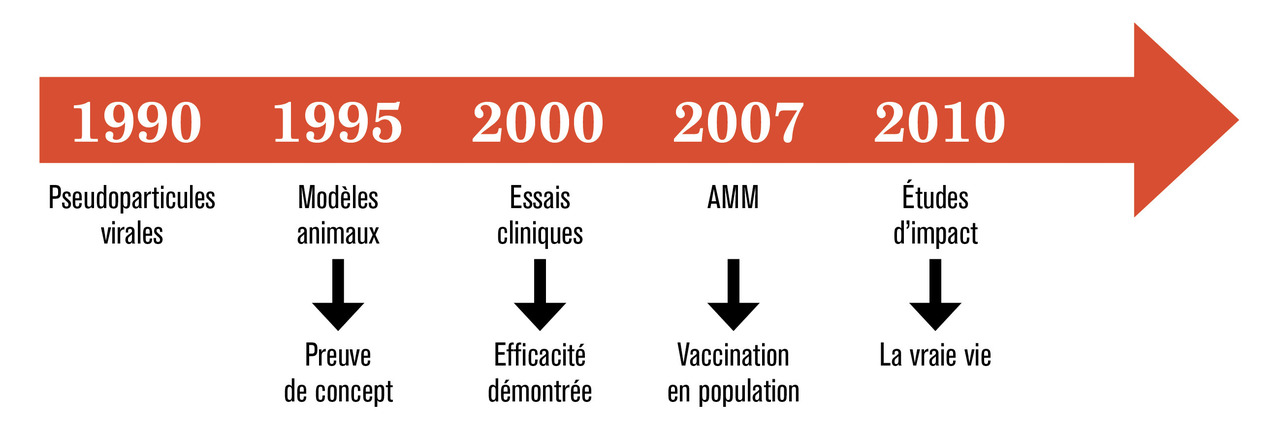
Pseudoparticules virales : les agents vaccinaux
Preuve de concept : les modèles animaux
Un premier travail2 a montré que la vaccination de chiens à l’aide de pseudoparticules virales de CoPV produites in vitro permettait de protéger 100 % des animaux contre le développement de lésions après inoculation expérimentale de CoPV. Ces auteurs ont aussi observé que la vaccination n’était plus efficace lorsque les pseudo-particules virales étaient au préalable traitées par un agent dénaturant. Cette observation confirme que la structure des pseudoparticules virales est essentielle à leur immunogénicité. En effet, des études antérieures avaient indiqué que l’utilisation de polypeptides dénaturés de L1 ne permettait pas une bonne immunisation. Par ailleurs, la vaccination des animaux par des pseudoparticules virales issues d’un papillomavirus humain (HPV 11) ne les protégeait pas contre les lésions induites par le virus canin, indiquant l’absence de protection croisée.2 Un second travail conduit chez le lapin a aussi montré des résultats spectaculaires. La vaccination des animaux par trois injections de pseudoparticules virales de CRPV a permis de protéger la quasi-totalité des lapins contre le développement de verrues après inoculation des virus. Dans les rares cas où des verrues sont apparues, aucune n’a dégénéré en tumeur. En revanche, l’apparition de verrues persistantes et une progression de ces verrues en carcinomes ont été documentées chez les lapins non immunisés ou immunisés par des pseudoparticules virales dénaturées ou produites à partir de la protéines L1 du virus bovin.3 De façon intéressante, le transfert passif d’immunoglobulines purifiées de chiens ou de lapins immunisés par des pseudoparticules virales à des animaux naïfs les protégeait d’une infection expérimentale, confirmant le rôle des anticorps neutralisants dans l’efficacité de la vaccination. Enfin, la protection conférée par l’immunisation par les pseudoparticules virales de CRPV était prolongée dans le temps puisque les animaux vaccinés étaient protégés jusqu’à un an après immunisation.4
Essais cliniques : le rationnel scientifique et médical
À la même période, l’étude princeps de protection était menée chez 2 400 jeunes femmes de 16 à 23 ans. Il s’agissait d’une étude randomisée en double aveugle pour évaluer l’efficacité de l’immunisation (trois injections) par des pseudoparticules virales HPV 16 sur les infections transitoires (détection d’HPV 16 au niveau du col de l’utérus à une seule visite) et persistantes (détection d’HPV 16 à plusieurs visites) à HPV 16.6 Finalement, 1 523 jeunes femmes ont été suivies pendant 17 mois, 765 ayant reçu le placebo et 768 ayant reçu le vaccin. Seulement 6 sujets ont eu une infection transitoire dans le groupe « femmes vaccinées » contre 68 dans le groupe placebo. Aucune jeune femme vaccinée n’a finalement été infectée de façon persistante alors que 41 l’ont été dans le groupe placebo. Ainsi, l’efficacité vaccinale a été évaluée à 91 % (intervalle de confiance [IC] à 95 % : 80-97) contre les infections transitoires et à 100 % (IC à 95 % : 90-100) contre les infections persistantes par HPV 16. Durant cette étude, 9 jeunes femmes ont développé une lésion de haut grade du col de l’utérus. Elles appartenaient toutes au groupe placebo.6
Deux vaccins ont ensuite été testés dans deux essais cliniques d’efficacité de grande ampleur ayant inclus près de 35 000 sujets (environ 18 000 pour chacun des deux essais cliniques) parmi lesquels la moitié a reçu un vaccin et l’autre moitié un placebo. Il s’agit des études PATRICIA, testant Cervarix, un vaccin bivalent fabriqué par GSK et ciblant les HPV 16 et 18 et FUTURE, évaluant Gardasil, un vaccin quadrivalent fabriqué par Merk et ciblant les HPV 16, 18, 6 et 11. Le principal critère d’évaluation clinique utilisé a été l’apparition d’une lésion de haut grade prouvée histologiquement et associée à HPV 16 ou 18. Pour le vaccin quadrivalent, un autre critère d’évaluation a été l’apparition de condylomes anogénitaux induits par les HPV 6 et 11. Après un suivi de 3 ans, les principaux résultats ont montré que l’efficacité vaccinale du vaccin bivalent était de 98,1 %,7 et celle du vaccin quadrivalent de 99 %8 en « per protocole ». Gardasil a aussi montré une efficacité de 99 % dans la prévention des condylomes anogénitaux associés à HPV 6 et 11.9 Aucun effet indésirable majeur n’a été rapporté dans ces essais. L’efficacité clinique des deux vaccins était étroitement liée à leur efficacité contre les infections par les papillomavirus ciblés, qu’elles soient transitoires ou persistantes. En 2014, une équipe a publié une revue de la littérature montrant que l’efficacité vaccinale restait optimale jusqu’à près de 10 années après la vaccination,10 suggérant qu’il ne serait probablement pas nécessaire d’effectuer une injection de rappel. En 2018, une revue systématique dans Cochrane, analysant les résultats de 26 essais cliniques ayant inclus près de 75 000 sujets, indiquait que la vaccination antipapillomavirus chez des jeunes femmes de 15 à 26 ans avait permis une réduction du nombre de lésions de haut grade ou plus (CIN2+) liées aux HPV 16 et 18 de 164 à 2/10 000.11 Le risque d’effets indésirables n’était pas différent entre les groupes « vaccinées » et placebo.11
Au-delà de la protection contre les lésions du col de l’utérus, la vaccination contre les papillomavirus a démontré une excellente efficacité (de l’ordre de 95 %) contre les lésions vulvaires, vaginales et anales, quelque soit le grade, y compris chez les hommes. Des analyses ont aussi été conduites pour évaluer l’efficacité de la vaccination contre les infections par les papillomavirus non ciblés par les vaccins et les lésions qui leur sont associées. Ainsi, et en particulier pour le vaccin bivalent, des protections croisées ont été documentées contre les infections par les papillomavirus les plus proches sur le plan phylogénétique des papillomavirus vaccinaux (HPV 31, 33, 45 et 52) et des CIN2+ associées à HPV 31, 33 et 45.12 Une question demeure toutefois sur la persistance dans le temps de cette protection croisée dans la mesure où elle a tendance à diminuer avec la durée du suivi.
Merck a aussi développé un vaccin nonavalent ciblant cinq génotypes supplémentaires de papillomavirus à haut risque : HPV 31, 33, 45, 52 et 58. Une étude randomisée en double aveugle chez 14 000 sujets a été menée pour évaluer son efficacité par rapport à celle du vaccin quadrivalent. Le vaccin nonavalent s’est avéré très immunogène, induisant plus de 99 % de séroconversion. Il est aussi efficace que le quadrivalent pour protéger contre les infections à HPV 16, 18, 6 et 11 et contre les lésions associées (col, vulve, vagin). Dans l’analyse finale, le vaccin nonavalent confère une réduction du risque de lésions, quel que soit le grade, associées aux HPV 31, 33, 45, 52 et 58 à ces sites d’environ 97 % par rapport au vaccin quadrivalent.13 En théorie, le vaccin nonavalent doit protéger contre l’apparition de plus de 90 % des cancers du col de l’utérus.
Études d’impact : l’efficacité dans la vraie vie
Modélisations : vers une éradication du cancer du col de l’utérus
Des preuves contre les infox
Papillomavirus : la vaccination en pratique
La vaccination contre les papillomavirus concerne les jeunes filles et les jeunes garçons (recommandation du 16 décembre 2019) de 11 à 14 ans, avec un rattrapage jusqu’à 19 ans. Ce rattrapage va jusqu’à 26 ans chez les hommes qui ont (ou ont eu) des relations sexuelles avec d’autres hommes. Deux à trois injections sont nécessaires en fonction de l’âge auquel la vaccination est initiée.
Avec Gardasil : deux doses espacées de 6 mois entre 11 et 13 ans révolus ; trois doses à 0, 2 et 6 mois entre 14 et 19 ans révolus.
Avec Cervarix : deux doses espacées de 6 à 13 mois entre 11 et 14 ans révolus ; trois doses à 0, 1 et 6 mois entre de 15 et 19 ans révolus.
Avec Gardasil 9 : deux doses espacées de 6 mois entre 11 et 14 ans révolus ; trois doses à 0, 2 et 6 mois entre 15 et 19 ans révolus.
Les garçons doivent être vaccinés à l’aide du vaccin Gardasil ou Gardasil 9 car ils protègent des infections par les HPV 6 et HPV 11, responsables de condylomes. Enfin, toute nouvelle vaccination doit être initiée avec le vaccin Gardasil 9 qui protège contre neuf types de papillomavirus. Toute vaccination initiée par un type vaccin doit être poursuivie avec le même vaccin, ils ne sont pas interchangeables.
Questions non résolues
Si la question de la vaccination des garçons a été tranchée en décembre 2019 par la Haute Autorité de santé, il n’en reste pas moins que l’âge du rattrapage n’est pas le même en fonction de l’orientation sexuelle. Est-ce que ce distinguo est encore nécessaire ? Une couverture vaccinale importante des garçons (au-delà de 60 à 70 %) pourrait rendre cette recommandation différentielle inutile. En revanche, une couverture vaccinale faible pourrait justifier un âge de rattrapage plus élevé chez les hommes ayant des relations sexuelles avec des hommes, car ils constituent une population particulièrement vulnérable aux lésions associées aux papillomavirus. Un autre point concerne l’avenir des vaccins quadrivalent et bivalent face au vaccin nonavalent. Ce dernier vaccin, qui protège des condylomes, aura aussi un impact plus important sur les lésions précancéreuses du col de l’utérus.
2. Suzich JA, Ghim SJ, Palmer-Hill FJ, et al. Systemic immunization with papillomavirus L1 protein completely prevents the development of viral mucosal papillomas. Proc Natl Acad Sci USA 1995;92:11553-7.
3. Breitburd F, Kirnbauer R, Hubbert NL, et al. Immunization with viruslike particles from cottontail rabbit papillomavirus (CRPV) can protect against experimental CRPV infection. J Virol 1995;69:3959-63.
4. Christensen ND, Reed CA, Cladel NM, Han R, Kreider JW. Immunization with viruslike particles induces long-term protection of rabbits against challenge with cottontail rabbit papillomavirus. J Virol 1996;70:960-5.
5. Harro CD, Pang YY, Roden RB, et al. Safety and immunogenicity trial in adult volunteers of a human papillomavirus 16 L1 virus-like particle vaccine. J Natl Cancer Inst 2001;93:284-92.
6. Koutsky LA, Ault KA, Wheeler CM, et al. A controlled trial of a human papillomavirus type 16 vaccine. N Engl J Med 2002;347:1645-51.
7. Paavonen J, Naud P, Salmerón J, et al. Efficacy of human papillomavirus (HPV)-16/18 AS04-adjuvanted vaccine against cervical infection and precancer caused by oncogenic HPV types (PATRICIA): final analysis of a double-blind, randomised study in young women. Lancet 2009;374:301-14.
8. Ault KA, Future II study group. Effect of prophylactic human papillomavirus L1 virus-like-particle vaccine on risk of cervical intraepithelial neoplasia grade 2, grade 3, and adenocarcinoma in situ: a combined analysis of four randomised clinical trials. Lancet 2007;369:1861-8.
9. FUTURE II study group. Quadrivalent vaccine against human papillomavirus to prevent high-grade cervical lesions. N Engl J Med 2007;356:1915-27.
10. De Vincenzo R, Conte C, Ricci C, Scambia G, Capelli G. Long-term efficacy and safety of human papillomavirus vaccination. Int J Womens Health 2014;6:999-1010.
11. Arbyn M, Xu L, Simoens C, Martin-Hirsch PP. Prophylactic vaccination against human papillomaviruses to prevent cervical cancer and its precursors. Cochrane Database Syst Rev 2018;5:CD009069.
12. Malagón T, Drolet M, Boily MC, et al. Cross-protective efficacy of two human papillomavirus vaccines: a systematic review and meta-analysis. Lancet Infect Dis 2012;12:781-9.
13. Huh WK, Joura EA, Giuliano AR, et al. Final efficacy, immunogenicity, and safety analyses of a nine-valent human papillomavirus vaccine in women aged 16-26 years: a randomised, double-blind trial. Lancet 2017;390:2143-59.
14. Drolet M, Bénard É, Boily MC, et al. Population-level impact and herd effects following human papillomavirus vaccination programmes: a systematic review and meta-analysis. Lancet Infect Dis 2015;15:565-80.
15. Machalek DA, Garland SM, Brotherton JML, et al. Very low prevalence of vaccine human papillomavirus types among 18- to 35-year old australian women 9 years following implementation of vaccination. J Infect Dis 2018;217:1590-600.
16. Garland SM, Kjaer SK, Muñoz N, et al. Impact and effectiveness of the quadrivalent human papillomavirus vaccine: a systematic review of 10 years of real-world experience. Clin Infect Dis 2016;63:519-27.
17. Luostarinen T, Apter D, Dillner J, et al. Vaccination protects against invasive HPV-associated cancers. Int J Cancer 2018;142:2186-7.
18. Miranda S, Chaignot C, Collin C, Dray-Spira R, Weill A, Zureik M. Human papillomavirus vaccination and risk of autoimmune diseases: A large cohort study of over 2million young girls in France. Vaccine 2017;35:4761-8.
19. Kostaras D, Karampli E, Athanasakis K. Vaccination against HPV virus: a systematic review of economic evaluation studies for developed countries. Expert Rev Pharmacoecon Outcomes Res 2019;19:147-58.
20. Simms KT, Steinberg J, Caruana M, et al. Impact of scaled up human papillomavirus vaccination and cervical screening and the potential for global elimination of cervical cancer in 181 countries, 2020-99: a modelling study. Lancet Oncol 2019;20:394-407.

 Encadrés
Encadrés