Le terme de vieillissement mêle classiquement deux définitions : le vieillissement se réfère au passage du temps, alors que les altérations structurelles et fonctionnelles (v. Focus page 509 ) qui en résultent correspondent à la sénescence. La sémantique se complique si on prend en compte les publications anglo-saxonnes qui parlent de processus « dégénératif », qualificatif péjoratif, pourtant le plus utilisé. Le terme d’« involution », qui touche la colonne vertébrale comme toute structure vivante, est peut être le mieux adapté aux phénomènes morphologiques et fonctionnels.
Bien que le processus de vieillissement apparaisse incontestablement comme déterministe au niveau de l’ensemble du corps et des organes, les altérations qui en résultent et leur expression fonctionnelle surviennent de façon stochastique d’un sujet à l’autre et à des âges différents, si bien que certains ont pu avancer le concept de « vieillissement normal ». En fait, les critères de normalité sont impossibles à fixer clairement. Il s’agit au mieux d’un état de tolérance optimale aux altérations biologiques qui, au fil du temps, fragilisent inexorablement tous les systèmes vivants, ce qui nous renvoie en fin de compte au concept fondamental de robustesse propre à chaque système.
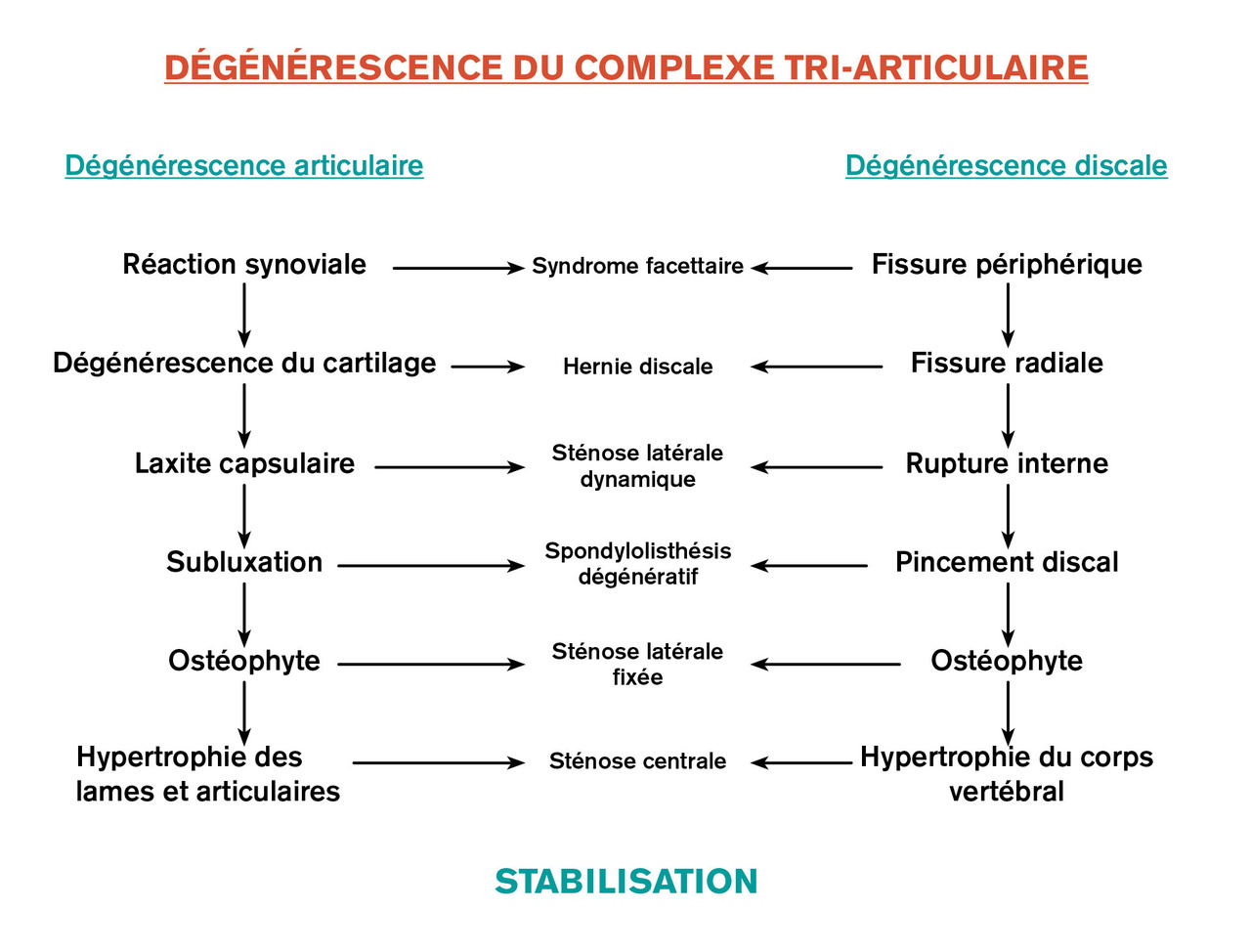
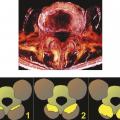
Lafigure 1 rappelle que, au niveau du rachis, les phénomènes dégénératifs touchent de façon concomitante et prédominante les éléments du complexe tri-articulaire de Junghans, c’est-à-dire le disque intervertébral et les articulaires postérieures, mais des phénomènes touchent aussi les ligaments, les muscles, l’os et le système nerveux contrôlant la colonne vertébrale.
Bien que le processus de vieillissement apparaisse incontestablement comme déterministe au niveau de l’ensemble du corps et des organes, les altérations qui en résultent et leur expression fonctionnelle surviennent de façon stochastique d’un sujet à l’autre et à des âges différents, si bien que certains ont pu avancer le concept de « vieillissement normal ». En fait, les critères de normalité sont impossibles à fixer clairement. Il s’agit au mieux d’un état de tolérance optimale aux altérations biologiques qui, au fil du temps, fragilisent inexorablement tous les systèmes vivants, ce qui nous renvoie en fin de compte au concept fondamental de robustesse propre à chaque système.
La
Disque intervertébral
Le disque intervertébral est soumis à de très importantes contraintes. Sa structure fibro-cartilagineuse bien organisée est très exposée au vieillissement et on constate de nombreuses altérations discales tout au long de l’existence. Le disque reste le tissu le plus dépourvu de cellules de l’organisme. Sa composition change avec l’âge : chez le sujet jeune ou d’âge moyen, il est riche en chondroïtine-4-sulfate, chondroïtine-6-sulfate et kératane sulfate ; chez le sujet âgé, le dermatane-sulfate est majoritaire.
Le disque intervertébral est généralement considéré comme un tissu avasculaire chez l’adulte. Cependant, on trouve chez le fœtus et le jeune enfant jusqu’à 2 ans des vaisseaux au sein même de l’annulus fibrosus sans pénétration dans le nucleus pulposus. Le disque du nouveau-né est vascularisé mais cette vascularisation diminue à l’âge adulte et peut augmenter en cas de pathologie.1 Le « vieillissement vasculaire » est très précoce dans la première décennie de la vie avec diminution drastique de la vascularisation entre 6 et 30 mois.2 Les plateaux vertébraux s’altèrent, associant fissures, amincissement et microfractures de l’os sous-chondral ; l’annulus périphérique se densifie secondairement.
Dès lors, la nutrition, précaire, se fait par diffusion à travers le réseau vasculaire vertébral au niveau des plateaux vertébraux. Le nucleus pulposus est le plus exposé sur le plan nutritionnel, étant le plus éloigné des vaisseaux. Une diminution de diffusion au sein du disque par sclérose de l’os sous-chondral ou à travers des plateaux calcifiés se traduit nécessairement par une diminution du flot sanguin et de la nutrition cellulaire concourant à la dégénérescence du nucleus pulposus, véritable amortisseur hydraulique de la colonne vertébrale.3
Le disque intervertébral est généralement considéré comme un tissu avasculaire chez l’adulte. Cependant, on trouve chez le fœtus et le jeune enfant jusqu’à 2 ans des vaisseaux au sein même de l’annulus fibrosus sans pénétration dans le nucleus pulposus. Le disque du nouveau-né est vascularisé mais cette vascularisation diminue à l’âge adulte et peut augmenter en cas de pathologie.1 Le « vieillissement vasculaire » est très précoce dans la première décennie de la vie avec diminution drastique de la vascularisation entre 6 et 30 mois.2 Les plateaux vertébraux s’altèrent, associant fissures, amincissement et microfractures de l’os sous-chondral ; l’annulus périphérique se densifie secondairement.
Dès lors, la nutrition, précaire, se fait par diffusion à travers le réseau vasculaire vertébral au niveau des plateaux vertébraux. Le nucleus pulposus est le plus exposé sur le plan nutritionnel, étant le plus éloigné des vaisseaux. Une diminution de diffusion au sein du disque par sclérose de l’os sous-chondral ou à travers des plateaux calcifiés se traduit nécessairement par une diminution du flot sanguin et de la nutrition cellulaire concourant à la dégénérescence du nucleus pulposus, véritable amortisseur hydraulique de la colonne vertébrale.3
Facteurs de vieillissement, surtout au niveau lombaire
L’architecture avasculaire finale du disque ainsi obtenue dès l’enfance, le vieillissement est plus ou moins lent en fonction des facteurs biomécaniques loco-régionaux, génétiques et nutritionnels par altération de la diffusion des micronutriments jusqu’au nucleus pulposus.
Le facteur génétique a été très étudié en comparant les imageries par résonance magnétique (IRM) des rachis de vrais jumeaux :4 les lésions discales sont très semblables alors que les activités physiques (professionnelles et sportives) varient ; manifestement, le facteur génétique l’emporte sur le facteur mécanique. Deux génotypes de métalloprotéinase 3 ont été déterminés : COL 9 A2 et COL 9 A3.4
L’étude5 d’une cohorte de plus de 300 jumeaux avec évaluation cervicale et lombaire par IRM a montré que la dégénérescence discale est héritée chez 74 % d’entre eux au niveau lombaire et 73 % au niveau cervical, concluant même à une part plus influente de la génétique dans ces phénomènes de vieillissement, à l’opposé des théories mécaniques plus traditionnelles.
Si ce facteur génétique est prépondérant, alors le vieillissement devrait se faire en tandem en régions cervicale et lombaire. C’est selon ce principe que 94 sujets asymptomatiques âgés de 48 ans en moyenne ont été analysés :6 78 % ont une dégénérescence cervicale et lombaire en tandem. On note cependant que seuls 21,3 % d’entre eux ont des pincements discaux et 12,8 % une sténose canalaire. Ces deux derniers paramètres sont relativement peu fréquents chez les populations asymptomatiques malgré une discrète augmentation avec l’âge.
Sur le plan histomorphologique, la dégénérescence discale est marquée par une diminution de l’hydratation des disques, parallèlement à la diminution de la concentration en glycosaminoglycanes. Des fissures se forment progressivement et peuvent former des poches d’azote. S’ensuit généralement une perte considérable d’élasticité du disque intervertébral avant même sa perte de hauteur. L’analyse différentielle du nucleus pulposus et de l’annulus fibrosus au cours du vieillissement montre d’importantes variations structurales histologiques, macroscopiques et microscopiques, ainsi qu’une modification substantielle de leur organisation cellulaire et moléculaire. Il y a une diminution de la cellularité discale avec l’âge sur les disques L4-L5.7 Cette diminution est d’autant plus importante que les cellules se trouvent au voisinage d’une fissure discale ou d’une anomalie cartilagineuse des plateaux vertébraux.7
Il existe au sein du disque un équilibre fragile entre synthèse et destruction matricielle ; de nombreux mécanismes moléculaires rompant cet équilibre (métalloprotéinases, voies d’apoptose, interleukines pro-inflammatoires) ont été proposés sans que l’on puisse leur attribuer définitivement un rôle de cause à effet. Une étude a montré une augmentation significative de l’incidence de l’apoptose cellulaire dans l’annulus fibrosus de disques de patients d’un groupe contrôle âgé (73 % ± 5,1 %) comparativement à un groupe nécessitant une discectomie (53,5 % ± 5,6 %), avec une différence d’âge de seulement 13 ans.8
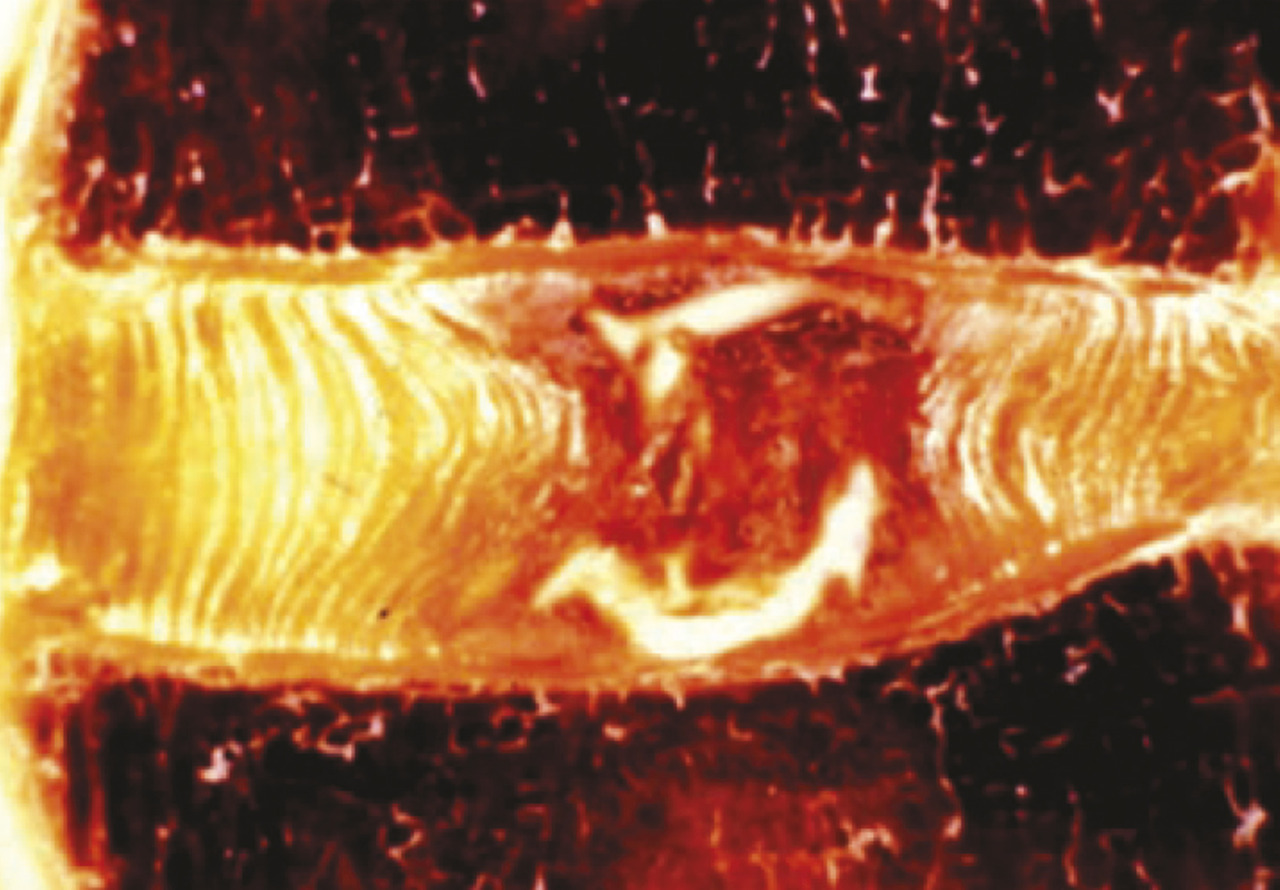
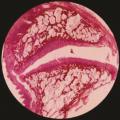
Il est communément reconnu que le pivot du vieillissement du rachis est le disque intervertébral. Ses lésions à type de déchirures radiaires et de fissures concentriques débutent dès la première décade de la vie (fig. 2 ). En réalité, une altération histologique du disque intervertébral existe dès l’âge de 3 ans.9 L’altération du nucleus pulposus en région lombaire est majeure chez les sujets de plus de 60 ans.
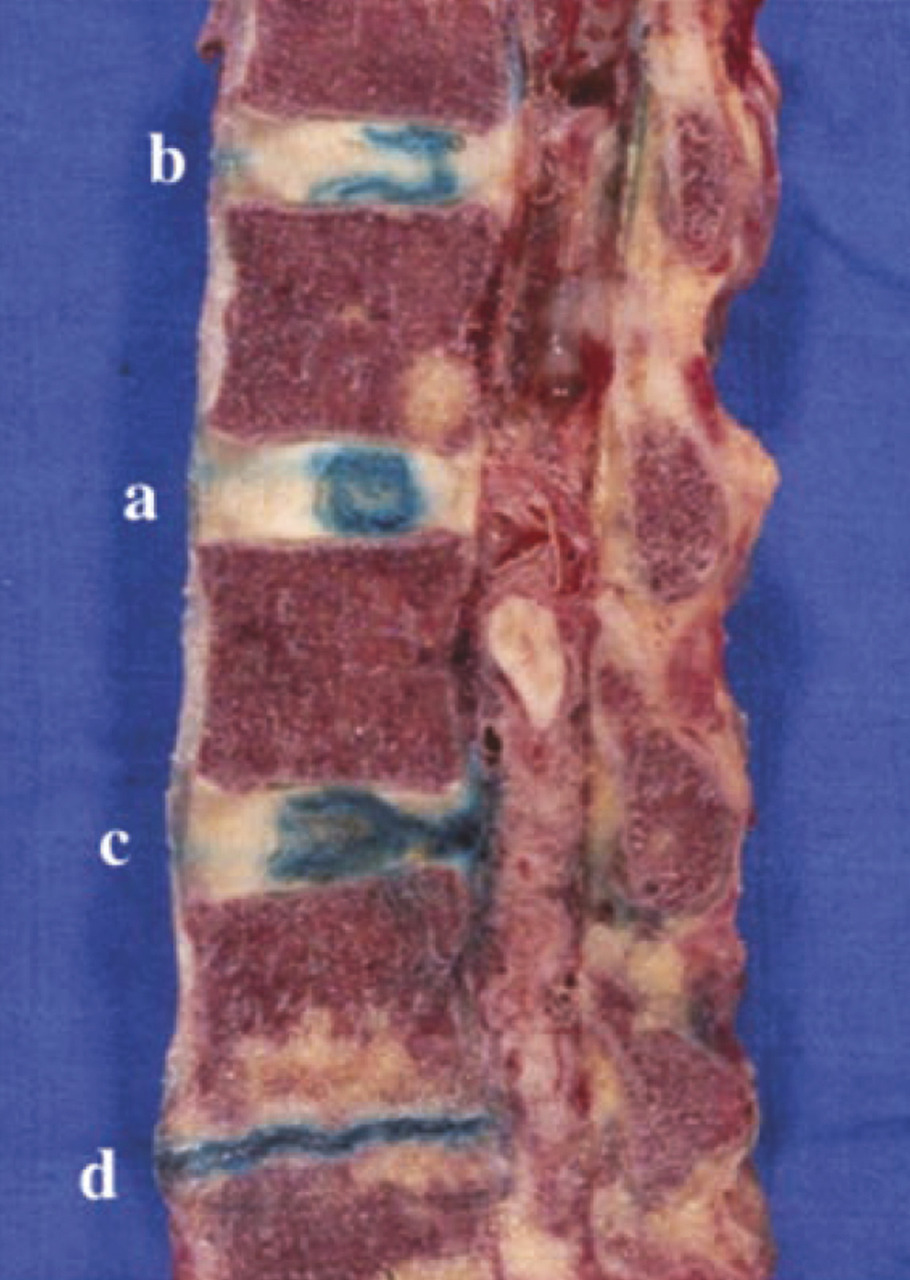
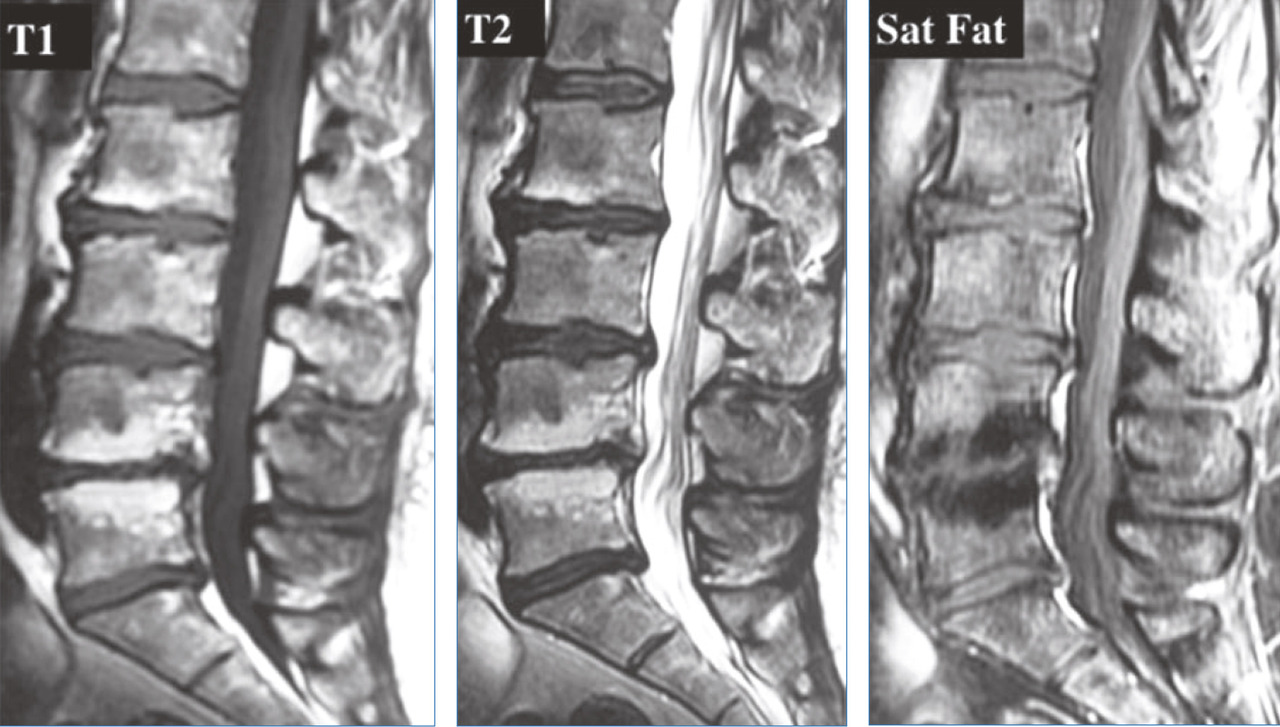
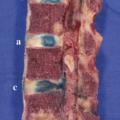
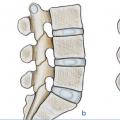
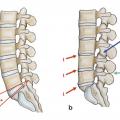
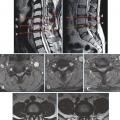
Il reste difficile à ce jour de clairement différencier les mécanismes du vieillissement des processus pathologiques de dégénérescence discale. Cependant, on considère que les lésions discales restent le primum movens du vieillissement du rachis impactant articulations zygaphophysaires, ligaments et muscles. Une équipe10 a montré de manière séquentielle les modifications morphologiques macroscopiques discales sur une étude cadavérique de 248 sujets d’âge croissant (de 7 mois à 88 ans) avec des spécimens incluant vertèbres et disques lombaires en coupes sagittales et parasagittales. Ses conclusions confirment que la transformation fibreuse du nucleus pulposus associée à une désorganisation de l’annulus et des plateaux anticipe les fissures du nucleus puis les déchirures discales plus étendues ; chez les sujets de 30 à 40 ans, on note des fissures du nucleus et des déchirures de l’annulus, fissures qui s’étendent dans le temps. Les lésions discales sont plus fréquentes à l’étage lombaire.10 Lafigure 3 montre que sur un même individu on peut observer un pincement (en d) avec une réaction graisseuse de l’os sous-chondral (v. infra) une fissure popstérieure (en c) et une fissure médiane (en b) ; seul le disque a, après injection de bleu de méthylène, comme à tous les niveaux, paraît normal.
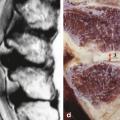
Au cours du vieillissement, le nucleus pulposus et l’annulus fibrosus deviennent plus fibreux et riches en collagène, et leur distinction devient moins évidente. Des calcifications se forment préférentiellement au niveau de l’annulus fibrosus mais parfois également au sein même du nucleus pulposus. Une néo-angiogenèse porteuse de cellules pro-inflammatoires a été montrée ;2 elle s’effectue à travers les plateaux vertébraux lésés et les fissures discales accélérant l’ossification du disque intervertébral et la production d’ostéophytes (en c sur lafigure 4 ).
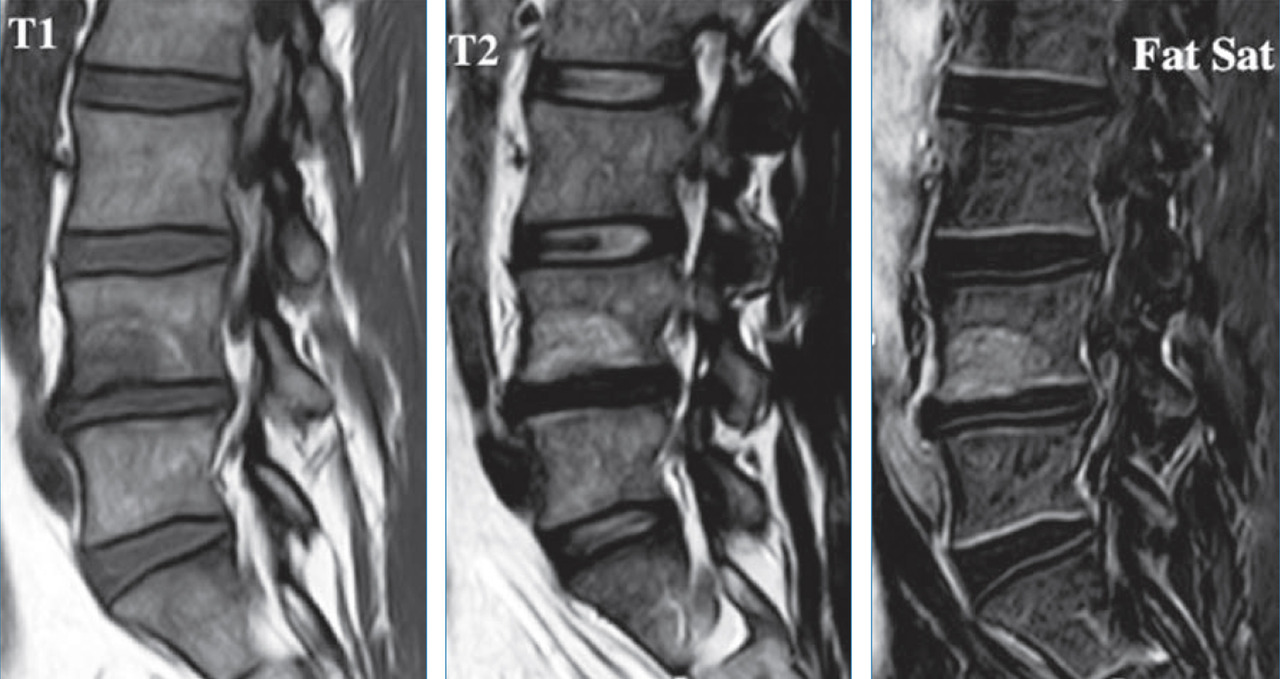
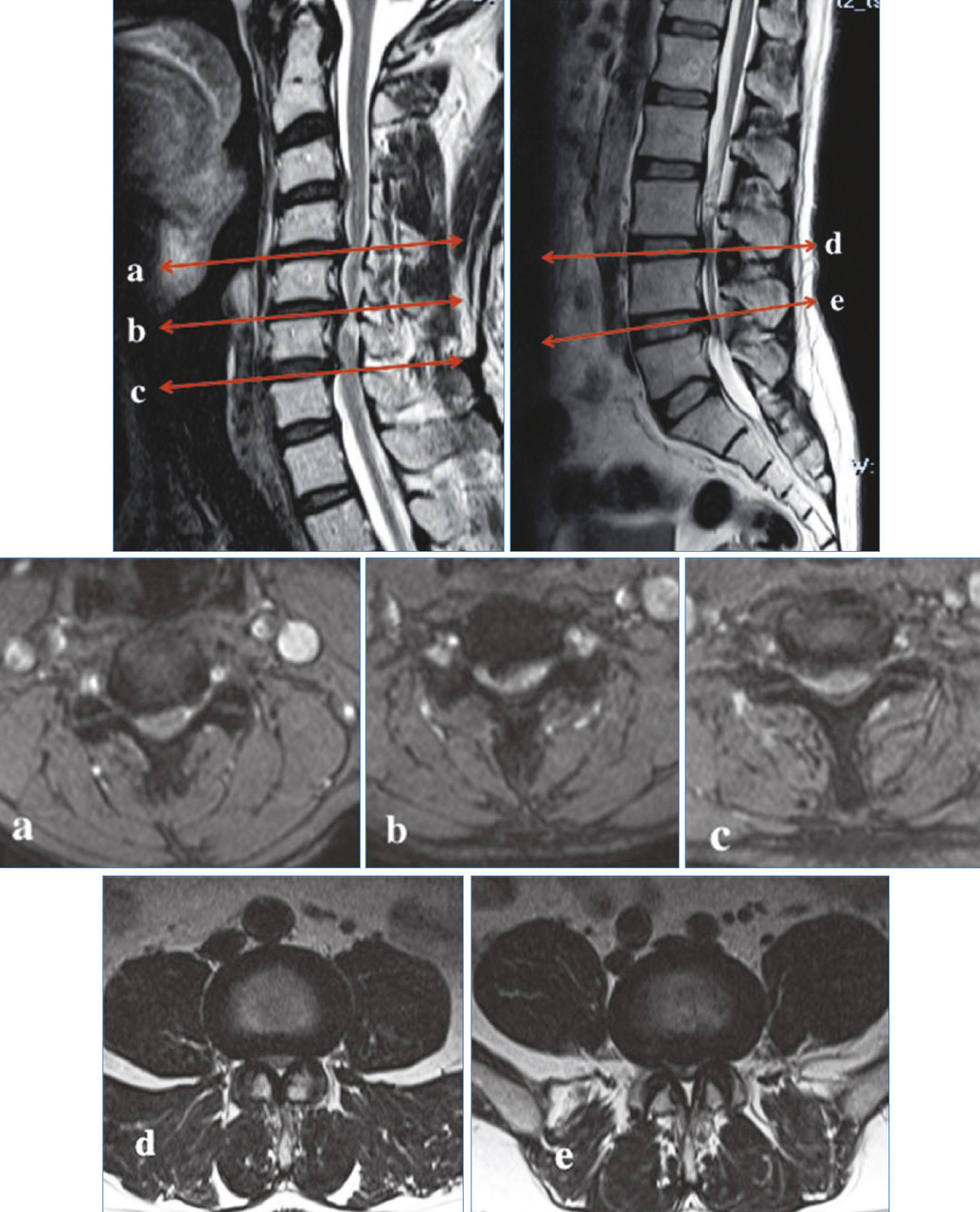
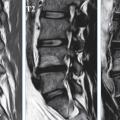
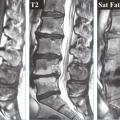
Il existe ainsi une cascade d’événements touchant le disque avec, dans un premier temps, une déshydratation précoce bien décrite dans les stades de dégénérescence en IRM de Pfirmann11 qui propose en 2001 une classification en 5 stades par IRM sur séquence T2 selon les critères suivants : structure et coloration (blanc/noir), distinction nucleus/annulus, intensité du signal, hauteur du disque intervertébral (fig. 5 ). La figure 6 montre cette évolution naturelle en IRM avec pincement et déshydratation.
Les fissures dans le nucleus et l’annulus apparaissent, et la hernie discale peut être une « étape sautée ».
Les plateaux cartilagineux et l’os sous-chondral présentent une atteinte inflammatoire (signal de Modic 1) par microfissures, probablement dues à l’argumentation des contraintes par défaut d’amortissement du disque : l’atteinte des plateaux est a priori secondaire à la défaillance discale, mais serait pour certains primitive avec retentissement sur la nutrition discale qui se fait par ces plaques cartilagineuses.
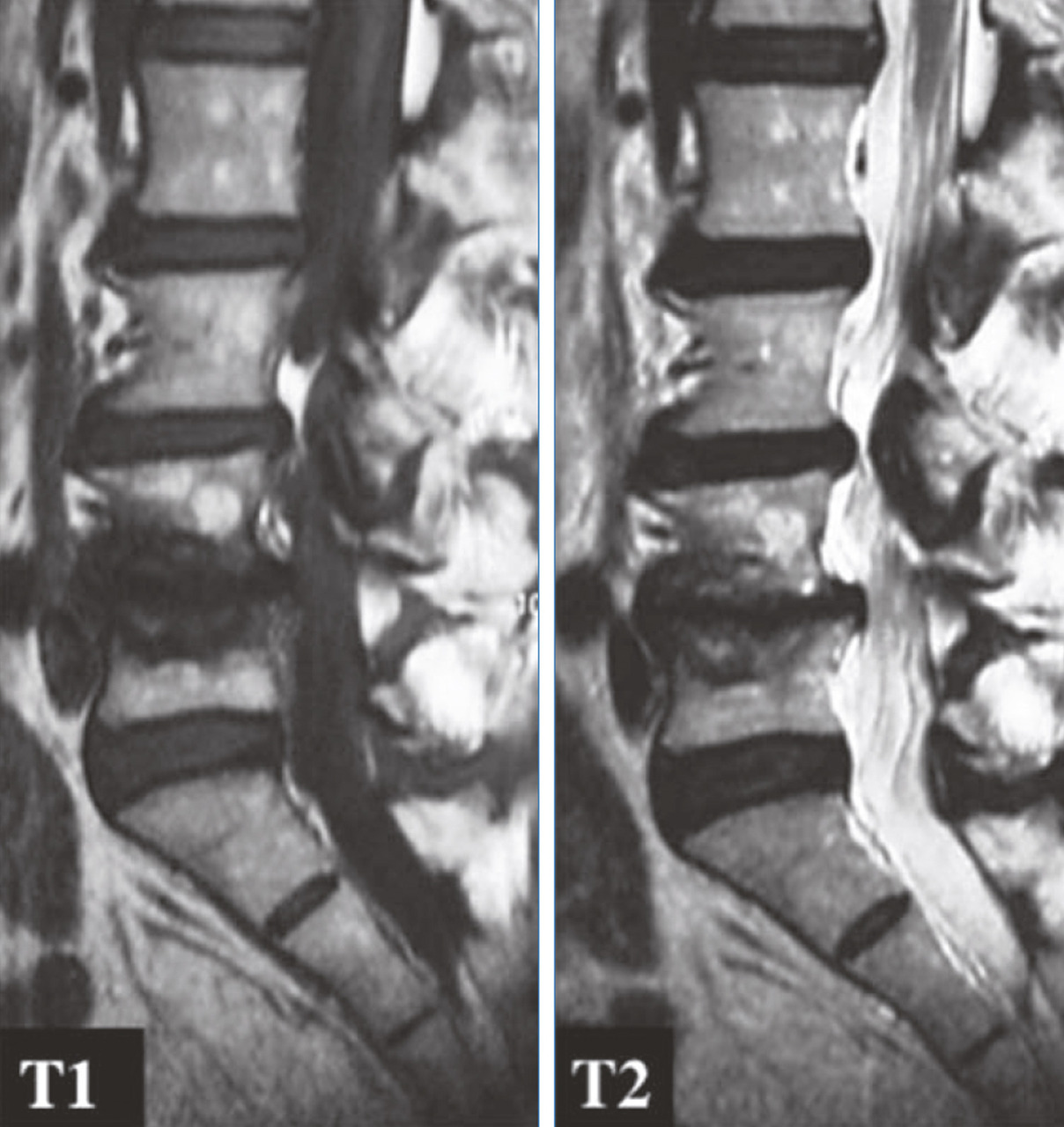
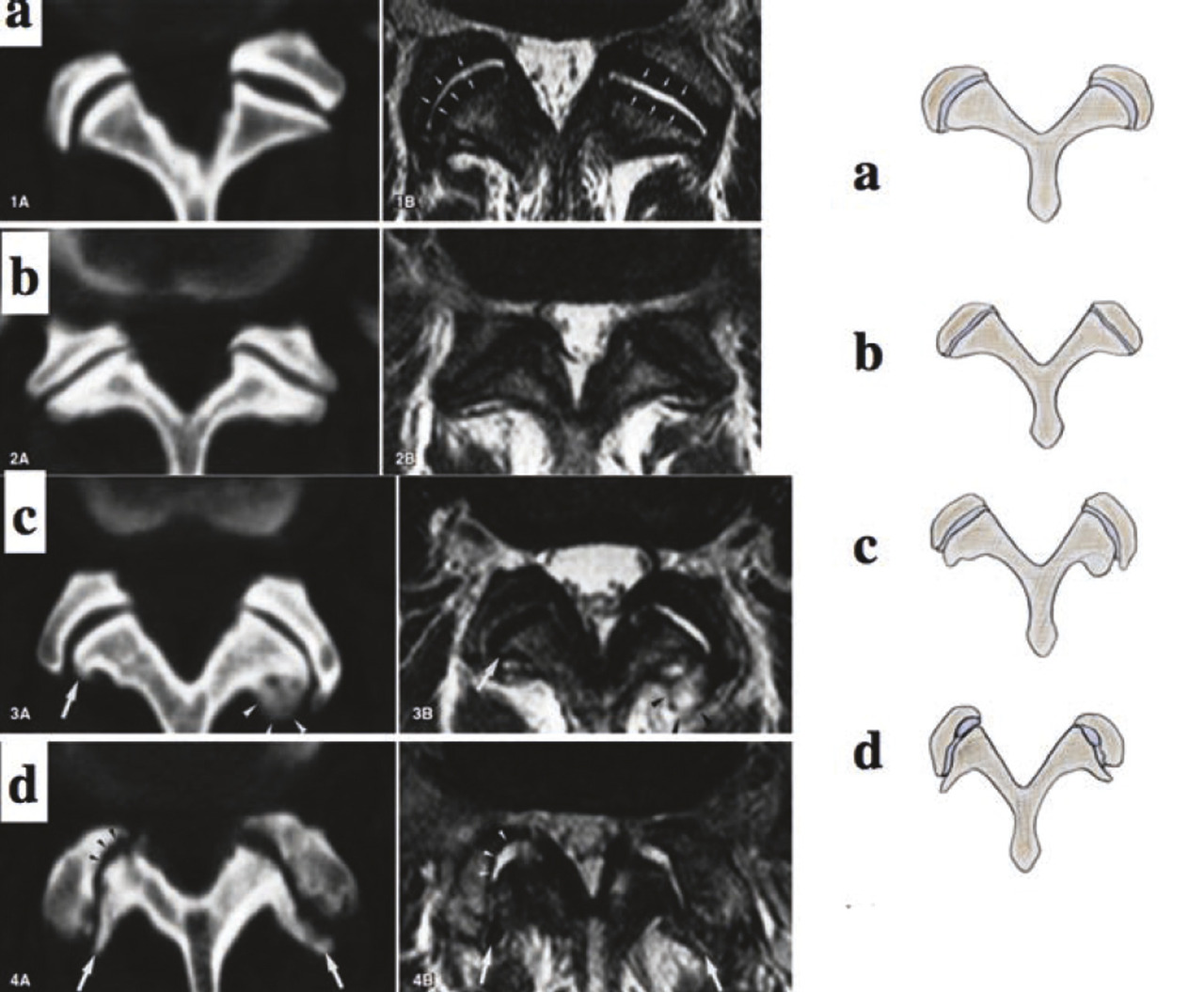
Une classification a été proposée en 1998,12 fondée sur la réaction inflammatoire des plateaux vertébraux notamment de la moelle osseuse vertébrale de l’os sous-chondral (fig. 7 à 9 ) :
– le type I combine hyposignal T1 et hypersignal T2, témoignant d’une hypervascularisation et réaction inflammatoire œdémateuse adjacente au disque de la moelle osseuse. Les études radiocliniques ont montré que ce type I était associé à un état douloureux avec handicap ;
– le type II associe hypersignal en T1 et T2, témoignant d’une involution graisseuse de la moelle. C’est un stade de cicatrisation du type I, donc moins voire non douloureux ;
– le type III, plus rare, correspondrait à une fibrose peu vascularisée et une hyperostose marquée, équivalente à une ostéocondensation. Il correspond probablement au stade de stabilisation de Kirkaldy-Willis;
– le dernier stade de dégénérescence est celui de la fusion discale faisant suite à une hypomobilité par pincement et fibrose discale, puis ostéophytose antérieure, postérieure et latérale.
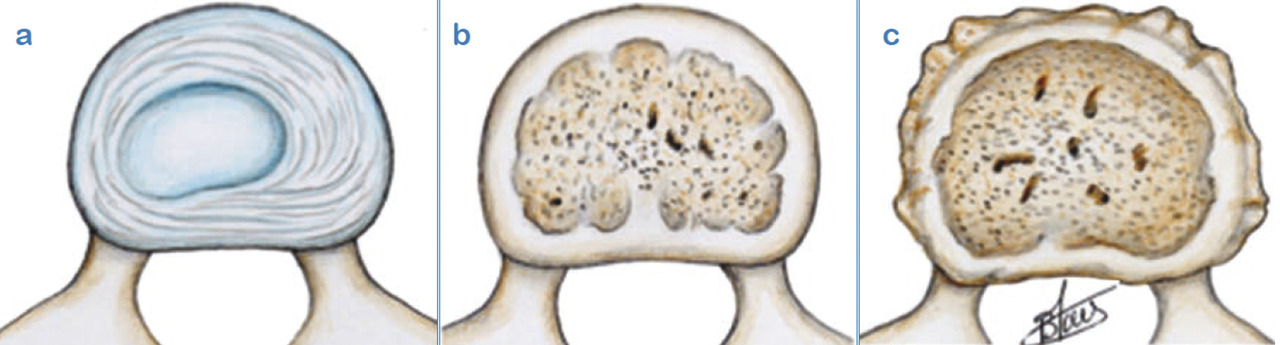
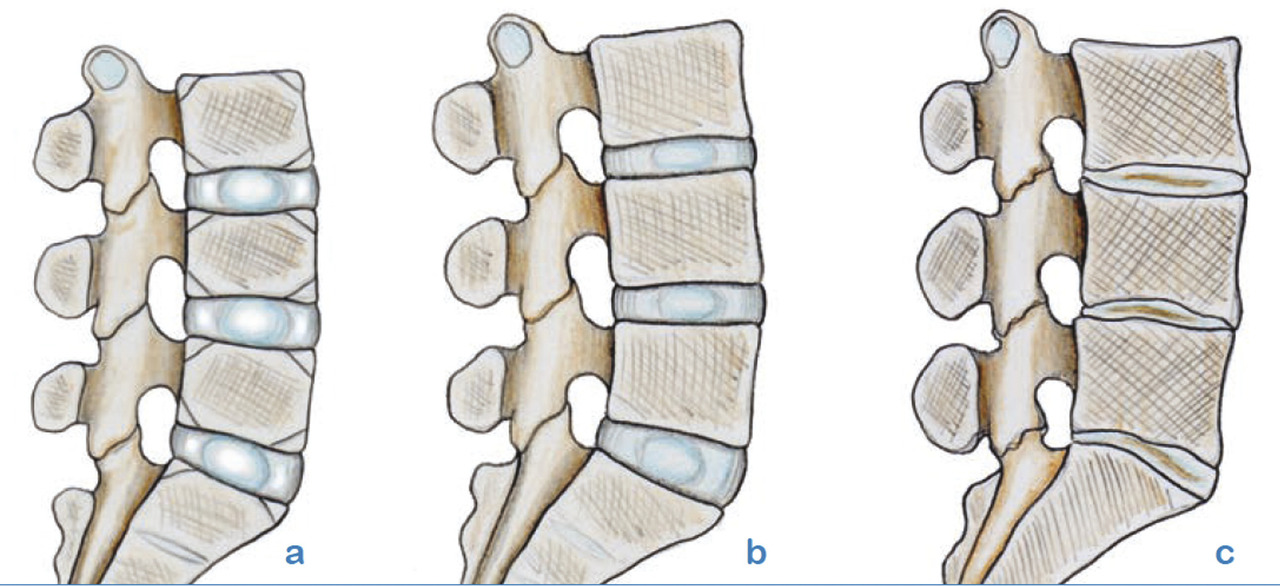
Lafigure 10 résume parfaitement l’évolution discale dominée par la déshydratation et la perte de hauteur du nouveau-né (en a), en passant à l’âge adulte (en b) et à un âge plus avancé (en c).
Concernant les phénomènes mécaniques, la répétition des charges en intensité et en rythme au même titre que les vibrations entraînent une calcification des cartilages des plateaux. Les mouvements de rotation exposent à la déchirure de l’annulus et aggravent le phénomène de fissuration déjà décrit. L’hypo-utilisation a aussi, par diminution de la stimulation cellulaire et altération des transports de nutriment, un effet néfaste au même titre que la différence brutale de mobilité et de rigidité comme on le voit dans les anomalies de charnière lombosacrée de Bertolotti et à la limite des arthrodèses chirurgicales.13
Des études expérimentales ont permis de mieux préciser l’effet des contraintes mécaniques sur le disque intervertébral et ses composants : augmentation de production de collagène de type 1 dans le nucleus pulposus sous l’effet de contraintes en compression, avec parallèlement, une diminution de fabrication de collagène de type 2 et de protéoglycanes ;14 diminution de production de protéoglycanes sous pression hydrostatique élevée (10 MPa) alors que cette synthèse augmente sous pression faible (1 MPa) ;15 des contraintes mécaniques directement appliquées aux cellules peuvent moduler la synthèse des protéines matricielles.16 Les effets observés sont vraisemblablement dépendants du type de contrainte, de son intensité, de sa fréquence et de sa durée.
Le rôle de l’inflammation est majeur :16 certaines métalloprotéases, cytokines et facteurs de croissance sont impliqués dans la dégénérescence discale ; il y aurait un lien direct entre contraintes mécaniques et activité métalloprotéasique.
La production de ces différents facteurs est discutée : cellules discales, néovascularisation ou granulome inflammatoire ?
L’hypovascularisation, notamment par microangiosclérose, est aussi un facteur de dégénérescence accélérée.17 Le tabagisme et les vibrations agiraient par ce biais vasculaire.3
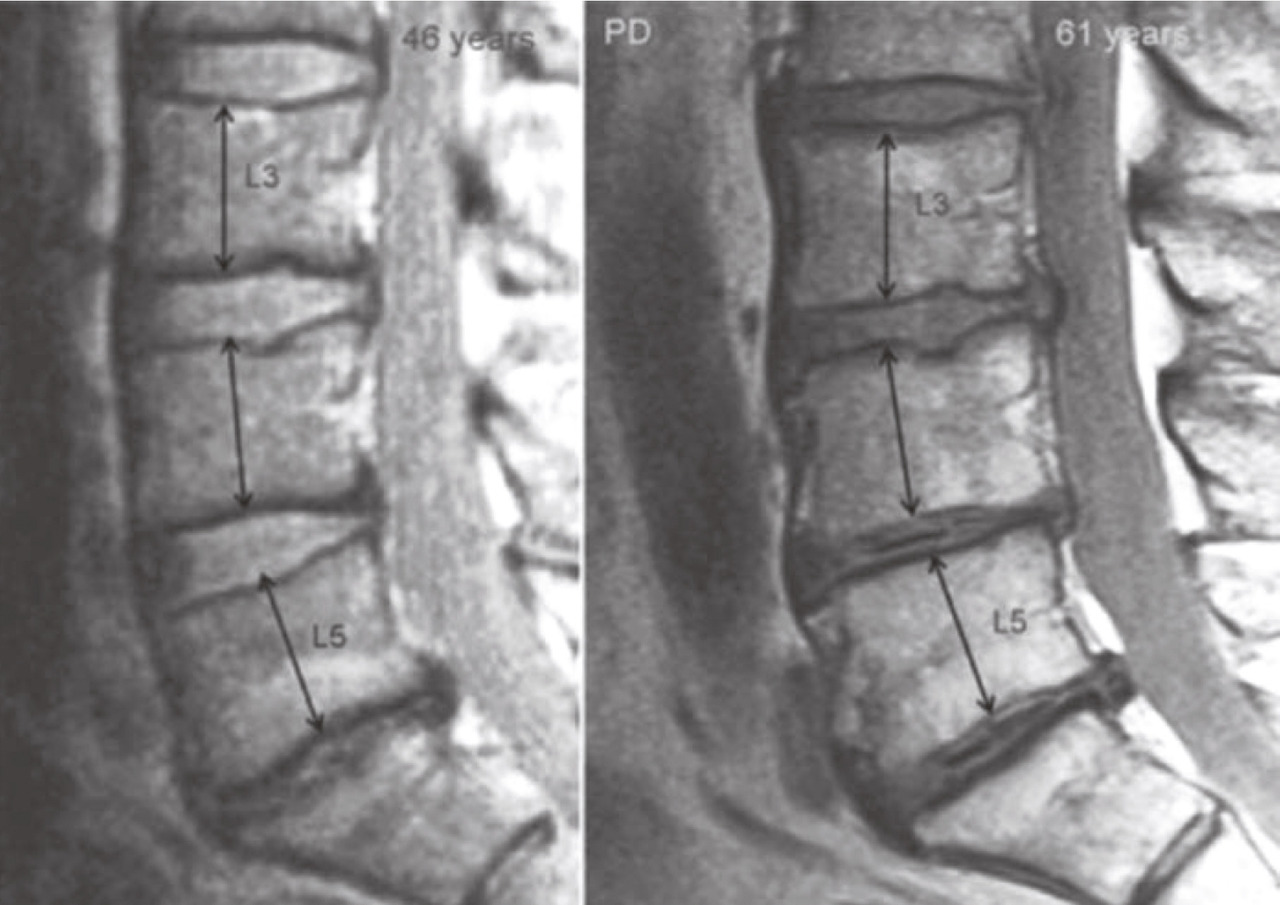
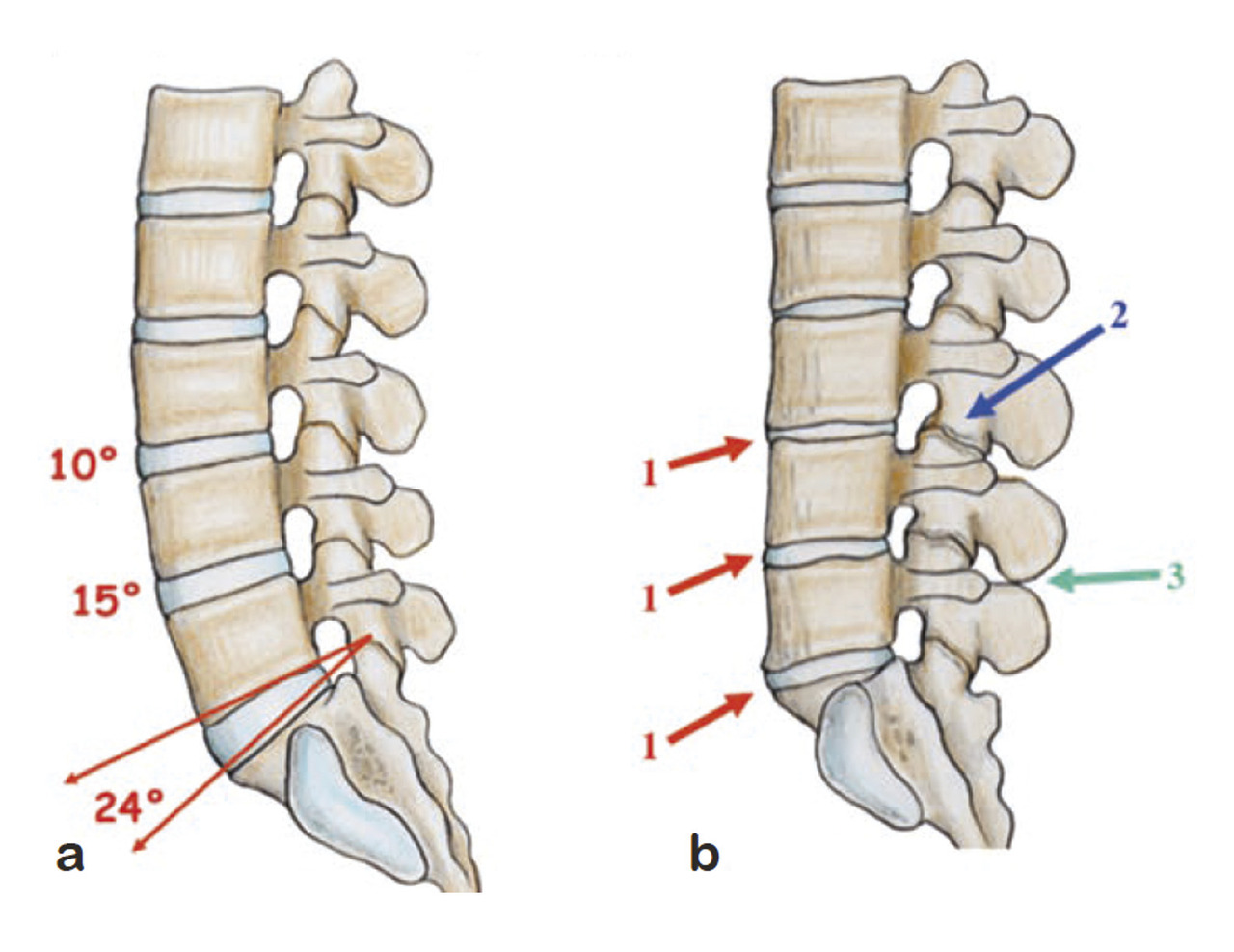
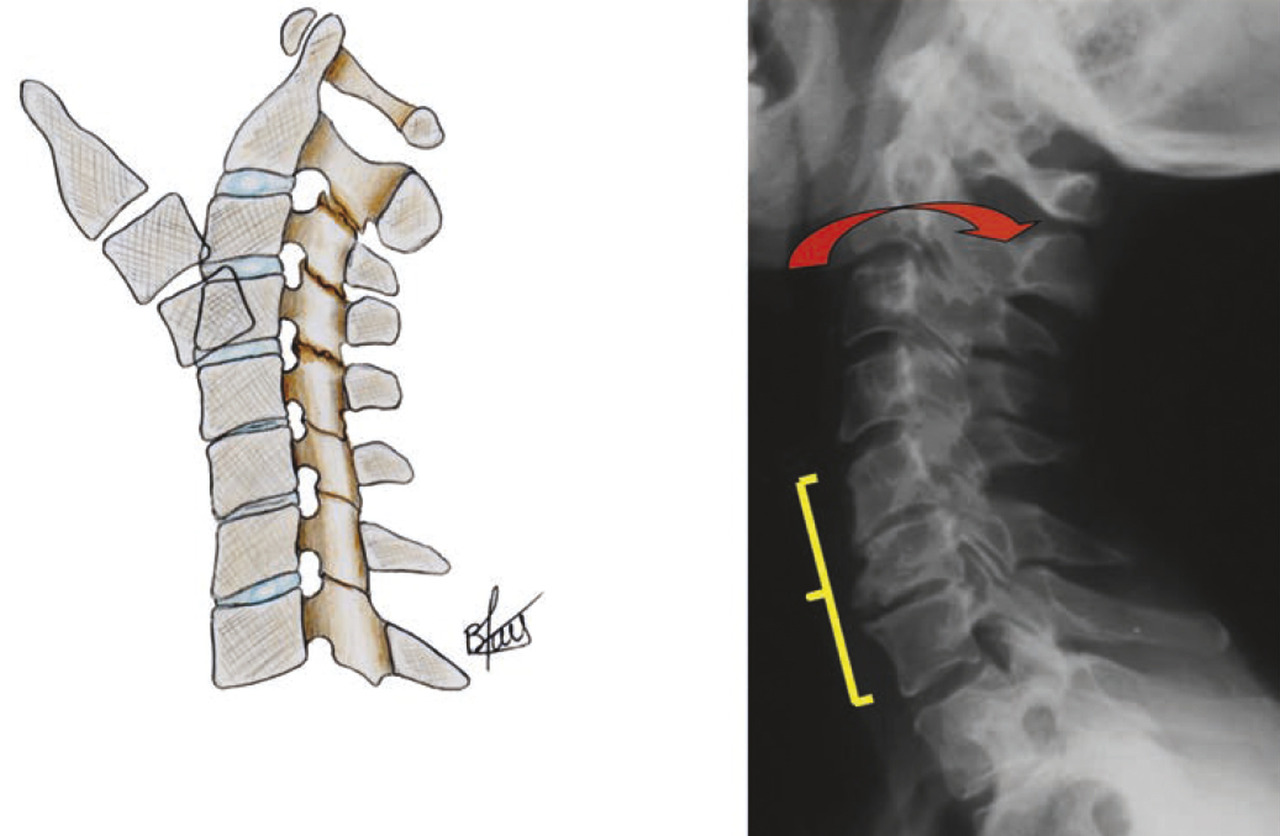
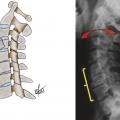
Une observation en IRM classique repose sur la déshydratation des disques lombaires bas (L4-L5 et L5-S1) survenant précocement par rapport aux disques lombaires hauts, suivie d’un pincement confirmé par les radiographies de profil. En effet, le vieillissement du rachis lombaire se « propage » de bas en haut, du fait de la position charnière de ces segments L5S1 voire L4L5 par rapport au bassin (fig. 11 ). Il en découle une perte de lordose très importante entre L4 et S1 où se situent deux tiers de la lordose lombaire. Le même phénomène existe au niveau cervical avec pincement premier des disques cervicaux bas (C7T1, C6C7 et C5C6 ) par effet de serrage et maintien prolongé de la hauteur des disques sus-jacents qui restent souvent hypermobiles notamment en extension pour maintenir le regard à l’horizontale (fig. 12 ).
Une étude pilote18 a utilisé l’IRM de diffusion pour détecter précocement des anomalies de comportement du disque à l’échelle moléculaire, en l’absence de toute anomalie morphologique en séquence T2, dues au vieillissement sur une série de sujets asymptomatiques. Il a été suggéré que le coefficient de diffusion pouvait diminuer dans les disques dégénérés et que celui-ci était corrélé avec la teneur discale en eau et l’intégrité ou non de la matrice discale en précisant la direction d’une éventuelle lésion.
Une méta-analyse19 réalisée en 2014 a permis de réunir les données concernant 3 310 sujets asymptomatiques avec des données radiographiques (tomodensitométrie ou IRM). Des signes de dégénérescence discale sont notés dès 20 ans pour 37 % des sujets asymptomatiques et 96 % des plus de 80 ans. Une diminution du signal discal en séquence IRM T2 est présente chez plus de la moitié des plus de 40 ans et 86 % des plus de 60 ans. La perte de hauteur discale est corrélée à l’âge mais dans une moindre mesure ; une augmentation de la prévalence de 1 % par an est toutefois notée. En revanche, la prévalence des protrusions discales et fissures annulaires ne semble pas croître avec l’âge.
Une hypothèse biomécanique novatrice concerne l’absorption des forces compressives du rachis chez les patients âgés.20 L’étude cadavérique sur segments thoracolombaires a montré que le vieillissement occasionnait une déformation des corps vertébraux concomitante à celle des disques intervertébraux au cours d’une mise en contrainte en compression. Les deux structures présentent un « fluage » substantiel. Plus les pressions discales sont faibles, plus les vertèbres se déforment sous l’action de la mise en charge.
Une étude21 a montré l’évolution naturelle morphologique par IRM des disques intervertébraux lombaires sur 15 ans sur une large série de jumeaux finlandais asymptomatiques. Les auteurs rapportent une diminution de hauteur discale moyenne de 3,4 % à 5 ans et de 8 à 11 % à 15 ans sur des IRM effectuées lors du suivi. L’originalité de ce travail a été de montrer une compensation par augmentation de hauteur vertébrale sur les niveaux incriminés de 3,1 % (0,8 mm) en région lombaire haute et 4,7 % (1,1 mm) en lombaire bas. Ces résultats préliminaires suggèrent une augmentation de hauteur des plateaux compensant les pertes de hauteur discale multi-étagées, ce qui conforte l’hypothèse novatrice biomécanique (v. supra).20
Le facteur génétique a été très étudié en comparant les imageries par résonance magnétique (IRM) des rachis de vrais jumeaux :4 les lésions discales sont très semblables alors que les activités physiques (professionnelles et sportives) varient ; manifestement, le facteur génétique l’emporte sur le facteur mécanique. Deux génotypes de métalloprotéinase 3 ont été déterminés : COL 9 A2 et COL 9 A3.4
L’étude5 d’une cohorte de plus de 300 jumeaux avec évaluation cervicale et lombaire par IRM a montré que la dégénérescence discale est héritée chez 74 % d’entre eux au niveau lombaire et 73 % au niveau cervical, concluant même à une part plus influente de la génétique dans ces phénomènes de vieillissement, à l’opposé des théories mécaniques plus traditionnelles.
Si ce facteur génétique est prépondérant, alors le vieillissement devrait se faire en tandem en régions cervicale et lombaire. C’est selon ce principe que 94 sujets asymptomatiques âgés de 48 ans en moyenne ont été analysés :6 78 % ont une dégénérescence cervicale et lombaire en tandem. On note cependant que seuls 21,3 % d’entre eux ont des pincements discaux et 12,8 % une sténose canalaire. Ces deux derniers paramètres sont relativement peu fréquents chez les populations asymptomatiques malgré une discrète augmentation avec l’âge.
Sur le plan histomorphologique, la dégénérescence discale est marquée par une diminution de l’hydratation des disques, parallèlement à la diminution de la concentration en glycosaminoglycanes. Des fissures se forment progressivement et peuvent former des poches d’azote. S’ensuit généralement une perte considérable d’élasticité du disque intervertébral avant même sa perte de hauteur. L’analyse différentielle du nucleus pulposus et de l’annulus fibrosus au cours du vieillissement montre d’importantes variations structurales histologiques, macroscopiques et microscopiques, ainsi qu’une modification substantielle de leur organisation cellulaire et moléculaire. Il y a une diminution de la cellularité discale avec l’âge sur les disques L4-L5.7 Cette diminution est d’autant plus importante que les cellules se trouvent au voisinage d’une fissure discale ou d’une anomalie cartilagineuse des plateaux vertébraux.7
Il existe au sein du disque un équilibre fragile entre synthèse et destruction matricielle ; de nombreux mécanismes moléculaires rompant cet équilibre (métalloprotéinases, voies d’apoptose, interleukines pro-inflammatoires) ont été proposés sans que l’on puisse leur attribuer définitivement un rôle de cause à effet. Une étude a montré une augmentation significative de l’incidence de l’apoptose cellulaire dans l’annulus fibrosus de disques de patients d’un groupe contrôle âgé (73 % ± 5,1 %) comparativement à un groupe nécessitant une discectomie (53,5 % ± 5,6 %), avec une différence d’âge de seulement 13 ans.8
Il est communément reconnu que le pivot du vieillissement du rachis est le disque intervertébral. Ses lésions à type de déchirures radiaires et de fissures concentriques débutent dès la première décade de la vie (
Il reste difficile à ce jour de clairement différencier les mécanismes du vieillissement des processus pathologiques de dégénérescence discale. Cependant, on considère que les lésions discales restent le primum movens du vieillissement du rachis impactant articulations zygaphophysaires, ligaments et muscles. Une équipe10 a montré de manière séquentielle les modifications morphologiques macroscopiques discales sur une étude cadavérique de 248 sujets d’âge croissant (de 7 mois à 88 ans) avec des spécimens incluant vertèbres et disques lombaires en coupes sagittales et parasagittales. Ses conclusions confirment que la transformation fibreuse du nucleus pulposus associée à une désorganisation de l’annulus et des plateaux anticipe les fissures du nucleus puis les déchirures discales plus étendues ; chez les sujets de 30 à 40 ans, on note des fissures du nucleus et des déchirures de l’annulus, fissures qui s’étendent dans le temps. Les lésions discales sont plus fréquentes à l’étage lombaire.10 La
Au cours du vieillissement, le nucleus pulposus et l’annulus fibrosus deviennent plus fibreux et riches en collagène, et leur distinction devient moins évidente. Des calcifications se forment préférentiellement au niveau de l’annulus fibrosus mais parfois également au sein même du nucleus pulposus. Une néo-angiogenèse porteuse de cellules pro-inflammatoires a été montrée ;2 elle s’effectue à travers les plateaux vertébraux lésés et les fissures discales accélérant l’ossification du disque intervertébral et la production d’ostéophytes (en c sur la
Il existe ainsi une cascade d’événements touchant le disque avec, dans un premier temps, une déshydratation précoce bien décrite dans les stades de dégénérescence en IRM de Pfirmann11 qui propose en 2001 une classification en 5 stades par IRM sur séquence T2 selon les critères suivants : structure et coloration (blanc/noir), distinction nucleus/annulus, intensité du signal, hauteur du disque intervertébral (
Les fissures dans le nucleus et l’annulus apparaissent, et la hernie discale peut être une « étape sautée ».
Les plateaux cartilagineux et l’os sous-chondral présentent une atteinte inflammatoire (signal de Modic 1) par microfissures, probablement dues à l’argumentation des contraintes par défaut d’amortissement du disque : l’atteinte des plateaux est a priori secondaire à la défaillance discale, mais serait pour certains primitive avec retentissement sur la nutrition discale qui se fait par ces plaques cartilagineuses.
Une classification a été proposée en 1998,12 fondée sur la réaction inflammatoire des plateaux vertébraux notamment de la moelle osseuse vertébrale de l’os sous-chondral (
– le type I combine hyposignal T1 et hypersignal T2, témoignant d’une hypervascularisation et réaction inflammatoire œdémateuse adjacente au disque de la moelle osseuse. Les études radiocliniques ont montré que ce type I était associé à un état douloureux avec handicap ;
– le type II associe hypersignal en T1 et T2, témoignant d’une involution graisseuse de la moelle. C’est un stade de cicatrisation du type I, donc moins voire non douloureux ;
– le type III, plus rare, correspondrait à une fibrose peu vascularisée et une hyperostose marquée, équivalente à une ostéocondensation. Il correspond probablement au stade de stabilisation de Kirkaldy-Willis;
– le dernier stade de dégénérescence est celui de la fusion discale faisant suite à une hypomobilité par pincement et fibrose discale, puis ostéophytose antérieure, postérieure et latérale.
La
Facteurs aggravants
Les facteurs aggravants ou accélérateurs de ces phénomènes de vieillissement sont mécaniques, vasculaires, génétiques et probablement intriqués.Concernant les phénomènes mécaniques, la répétition des charges en intensité et en rythme au même titre que les vibrations entraînent une calcification des cartilages des plateaux. Les mouvements de rotation exposent à la déchirure de l’annulus et aggravent le phénomène de fissuration déjà décrit. L’hypo-utilisation a aussi, par diminution de la stimulation cellulaire et altération des transports de nutriment, un effet néfaste au même titre que la différence brutale de mobilité et de rigidité comme on le voit dans les anomalies de charnière lombosacrée de Bertolotti et à la limite des arthrodèses chirurgicales.13
Des études expérimentales ont permis de mieux préciser l’effet des contraintes mécaniques sur le disque intervertébral et ses composants : augmentation de production de collagène de type 1 dans le nucleus pulposus sous l’effet de contraintes en compression, avec parallèlement, une diminution de fabrication de collagène de type 2 et de protéoglycanes ;14 diminution de production de protéoglycanes sous pression hydrostatique élevée (10 MPa) alors que cette synthèse augmente sous pression faible (1 MPa) ;15 des contraintes mécaniques directement appliquées aux cellules peuvent moduler la synthèse des protéines matricielles.16 Les effets observés sont vraisemblablement dépendants du type de contrainte, de son intensité, de sa fréquence et de sa durée.
Le rôle de l’inflammation est majeur :16 certaines métalloprotéases, cytokines et facteurs de croissance sont impliqués dans la dégénérescence discale ; il y aurait un lien direct entre contraintes mécaniques et activité métalloprotéasique.
La production de ces différents facteurs est discutée : cellules discales, néovascularisation ou granulome inflammatoire ?
L’hypovascularisation, notamment par microangiosclérose, est aussi un facteur de dégénérescence accélérée.17 Le tabagisme et les vibrations agiraient par ce biais vasculaire.3
Que montrent les études ?
Les études rapportant les observations cliniques et IRM des cohortes asymptomatiques concernant le vieillissement du disque intervertébral utilisent principalement des classifications fondées sur le disque (dérivées de la classification de Pfirmann11) sans prise en compte de la réaction inflammatoire des plateaux. En effet, les types de Modic, souvent attribués à des mécanismes pathologiques, sont moins étudiés dans le cadre du vieillissement du rachis chez des sujets asymptomatiques.Une observation en IRM classique repose sur la déshydratation des disques lombaires bas (L4-L5 et L5-S1) survenant précocement par rapport aux disques lombaires hauts, suivie d’un pincement confirmé par les radiographies de profil. En effet, le vieillissement du rachis lombaire se « propage » de bas en haut, du fait de la position charnière de ces segments L5S1 voire L4L5 par rapport au bassin (
Une étude pilote18 a utilisé l’IRM de diffusion pour détecter précocement des anomalies de comportement du disque à l’échelle moléculaire, en l’absence de toute anomalie morphologique en séquence T2, dues au vieillissement sur une série de sujets asymptomatiques. Il a été suggéré que le coefficient de diffusion pouvait diminuer dans les disques dégénérés et que celui-ci était corrélé avec la teneur discale en eau et l’intégrité ou non de la matrice discale en précisant la direction d’une éventuelle lésion.
Une méta-analyse19 réalisée en 2014 a permis de réunir les données concernant 3 310 sujets asymptomatiques avec des données radiographiques (tomodensitométrie ou IRM). Des signes de dégénérescence discale sont notés dès 20 ans pour 37 % des sujets asymptomatiques et 96 % des plus de 80 ans. Une diminution du signal discal en séquence IRM T2 est présente chez plus de la moitié des plus de 40 ans et 86 % des plus de 60 ans. La perte de hauteur discale est corrélée à l’âge mais dans une moindre mesure ; une augmentation de la prévalence de 1 % par an est toutefois notée. En revanche, la prévalence des protrusions discales et fissures annulaires ne semble pas croître avec l’âge.
Une hypothèse biomécanique novatrice concerne l’absorption des forces compressives du rachis chez les patients âgés.20 L’étude cadavérique sur segments thoracolombaires a montré que le vieillissement occasionnait une déformation des corps vertébraux concomitante à celle des disques intervertébraux au cours d’une mise en contrainte en compression. Les deux structures présentent un « fluage » substantiel. Plus les pressions discales sont faibles, plus les vertèbres se déforment sous l’action de la mise en charge.
Une étude21 a montré l’évolution naturelle morphologique par IRM des disques intervertébraux lombaires sur 15 ans sur une large série de jumeaux finlandais asymptomatiques. Les auteurs rapportent une diminution de hauteur discale moyenne de 3,4 % à 5 ans et de 8 à 11 % à 15 ans sur des IRM effectuées lors du suivi. L’originalité de ce travail a été de montrer une compensation par augmentation de hauteur vertébrale sur les niveaux incriminés de 3,1 % (0,8 mm) en région lombaire haute et 4,7 % (1,1 mm) en lombaire bas. Ces résultats préliminaires suggèrent une augmentation de hauteur des plateaux compensant les pertes de hauteur discale multi-étagées, ce qui conforte l’hypothèse novatrice biomécanique (v. supra).20
À l’étage cervical
Les modifications discales jouent un rôle majeur dans le vieillissement du rachis cervical. Sur une série de 223 sujets asymptomatiques de 39 ± 15 ans, un vieillissement morphologique significatif a été noté sur les IRM des rachis cervicaux après 10 ans de suivi ;23 34 % des patients ont développé des symptômes à type de cervicalgie, raideur des épaules ou troubles sensitifs subjectifs des membres inférieurs ; l’apparition de ces symptômes était corrélée à la dégénérescence discale visualisée à l’IRM. Les relations entre équilibre sagittal et dégénérescence discale au niveau cervical ont également été étudiées sur une large cohorte de sujets asymptomatiques à 10 ans de suivi.23 Il n’y a aucune corrélation entre les symptômes cliniques et l’équilibre sagittal cervical. Dans cette cohorte, la perte d’intensité du signal des disques, les protrusions discales postérieures et les pincements discaux sont notés chez respectivement 64,6 %, 65,5 % et 28,3 % des sujets à 10 ans de suivi. Les sujets de plus de 40 ans non lordosés sont les plus susceptibles de développer des protrusions discales postérieures.
Lésions en tandem lombaires et cervicales
On parle de lésions en tandem en montrant une prévalence de dégénérescence discale au niveau cervical inférieur chez les patients ayant déjà une hernie discale lombaire par rapport à des témoins asymptomatiques.23 Cette association de hernies lombaires et de discopathies cervicales suggère un effet « systémique » du vieillissement discal ainsi qu’une participation génétique importante (fig. 1 3).
Disque intervertébral thoracique
Peu d’auteurs ont étudié le vieillissement de ce disque. Une étude24 a montré, par IRM sur 94 sujets asymptomatiques, une dégénérescence des disques intervertébraux aux étages thoraciques chez 46,8 % des sujets étudiés. Parmi ces sujets, 37,2 % ont une diminution de l’intensité du signal discal en séquence T2, 30,9 % une protrusion discale postérieure et 29,8 % une compression du sac dural. Seuls 4,3 % ont un pincement discal à l’étage thoracique. L’étage thoracique, peu mobile, ne semble donc pas épargné par ces phénomènes de dégénérescence (plus de 25 % de hernies avec empreinte sur la dure-mère), malgré des contraintes mécaniques moindres qu’aux étages cervical et lombaire qui sont, à l’inverse, lordosés et mobiles.
Arc postérieur
Articulations zygapophysaires ou articulaires postérieures
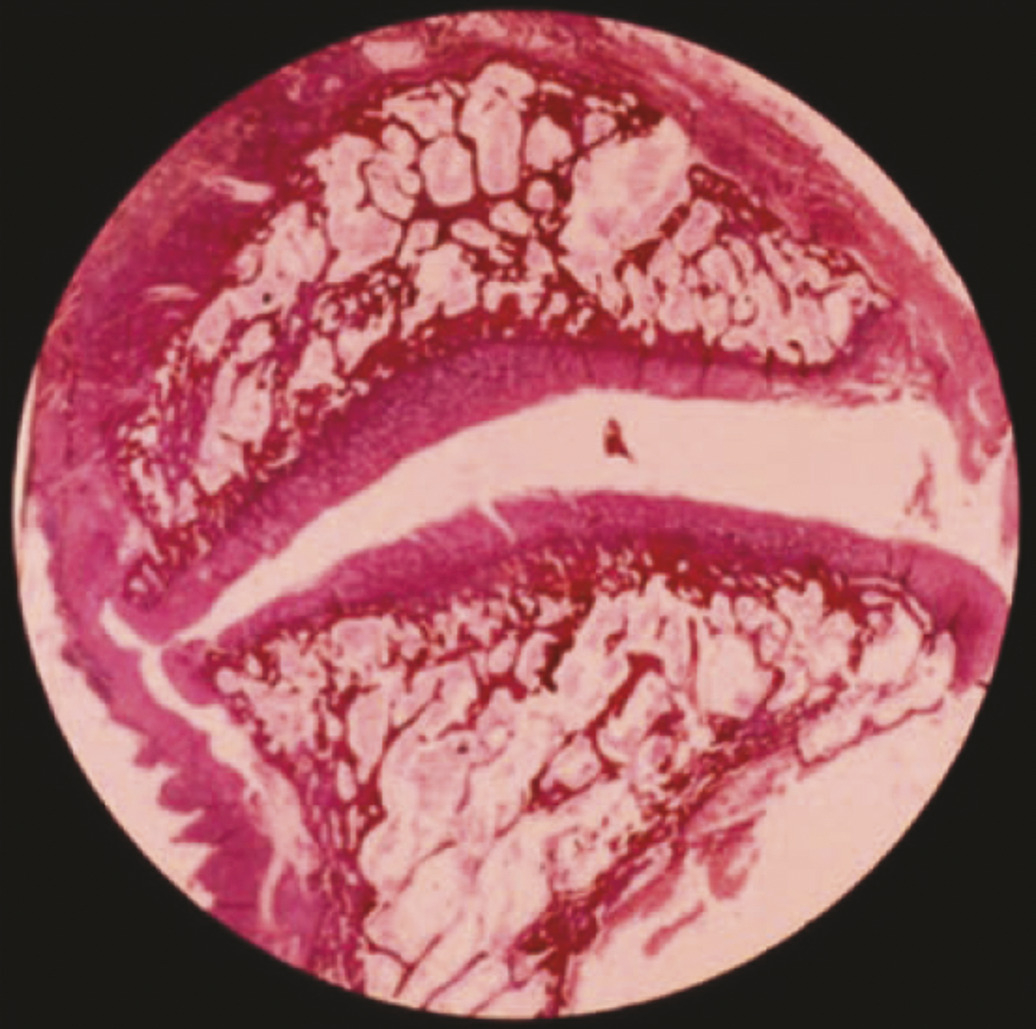
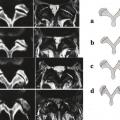
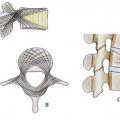
Deuxième constituant du segment mobile de Junghanns, elles suivent parallèlement au vieillissement discal une involution naturelle qui comprend des fissures du cartilage articulaire (fig. 14 ), parfois une érosion, des géodes sous-chondrales et, comme toute articulation touchée par l’arthrose, une hypertrophie avec ostéophytose qui peut aller jusqu’à la fusion complète avec le temps. L’évolution est décrite en 4 stades d’évolution des articulaires postérieures :25 stade 0 normal, stade 1 avec simple pincement, stade 2 avec petite géodes et ostéophytes et enfin stade 3 avec importants ostéophytes géodes et kystes synoviaux (fig. 15 ).
Le pincement de l’interligne articulaire est inexorable. Une sagittalisation progressive des articulaires lombaires basses se produit, probablement par augmentation des contraintes sur le tiers antérieur et supérieur de l’articulaire supérieure de la vertèbre inférieure qui va dans le sens du spondylolisthésis dégénératif.26
Les capsules articulaires peuvent aussi s’hypertrophier avec constitution de kystes synoviaux postérieurs ou antérieurs, pouvant comprimer les racines de la queue-de-cheval.
Les kystes sont associés à un spondylolisthésis dégénératif dans 60 à 89 % des cas. Une autre classification des stades de dégénérescence articulaire postérieure a été proposée,27 qui distingue en IRM quatre stades de dégénérescence cartilagineuse et quatre stades de sclérose subchondrale.
Le pincement de l’interligne articulaire est inexorable. Une sagittalisation progressive des articulaires lombaires basses se produit, probablement par augmentation des contraintes sur le tiers antérieur et supérieur de l’articulaire supérieure de la vertèbre inférieure qui va dans le sens du spondylolisthésis dégénératif.26
Les capsules articulaires peuvent aussi s’hypertrophier avec constitution de kystes synoviaux postérieurs ou antérieurs, pouvant comprimer les racines de la queue-de-cheval.
Les kystes sont associés à un spondylolisthésis dégénératif dans 60 à 89 % des cas. Une autre classification des stades de dégénérescence articulaire postérieure a été proposée,27 qui distingue en IRM quatre stades de dégénérescence cartilagineuse et quatre stades de sclérose subchondrale.
Épineuses
Une étude tomodensitométrique longitudinale a montré que la hauteur des épineuses augmentait avec les décennies ;28 cette évolution entraîne un phénomène d’encombrement postérieur qui réduit les capacités d’extension au même titre que les pincements discaux antérieurs qui sont d’ailleurs concomitants (fig. 16 ). Le contact entre les épineuses hypertrophiées peut être douloureux et s’appelle syndrome de Baastrup.
Ligaments
Le ligament jaune, le plus riche en élastine de l’organisme, a de nombreuses fibres proprioceptives comme le multifidus, au contact de sa face dorsale. Avec l’âge, il y a diminution de la concentration en élastine et donc perte d’élasticité. Les ligaments rachidiens peuvent non seulement s’hypertrophier et godronner, du fait du télescopage discal et articulaire, mais aussi avoir des dépôts de pyrophosphate de calcium ou d’hydroxyapatite, très fréquents dans les canaux lombaires étroits. Ces dépôts ne sont pas toujours associés aux antécédents tels que la chondrocalcinose, l’hyperparathyroïdie ou l’hémochromatose.
Le ligament longitudinal dorsal et notamment son faisceau médian peuvent se calcifier, surtout dans le cadre de la maladie de Forestier.
Le ligament longitudinal dorsal et notamment son faisceau médian peuvent se calcifier, surtout dans le cadre de la maladie de Forestier.
Muscles
La sarcopénie débute dès la trentaine avec une accélération à partir de 50 ans : la masse musculaire diminue de 1 à 2 % par an à partir de cet âge avec perte de force de 1,5 % par an, soit une perte de 30 % de force par décennie à partir de 60 ans. Il y a perte du nombre de fibres musculaires, à la fois de type 1 et de type 2. L’atrophie des fibres est aussi observée, et elle touche surtout les fibres rapides de type 2.
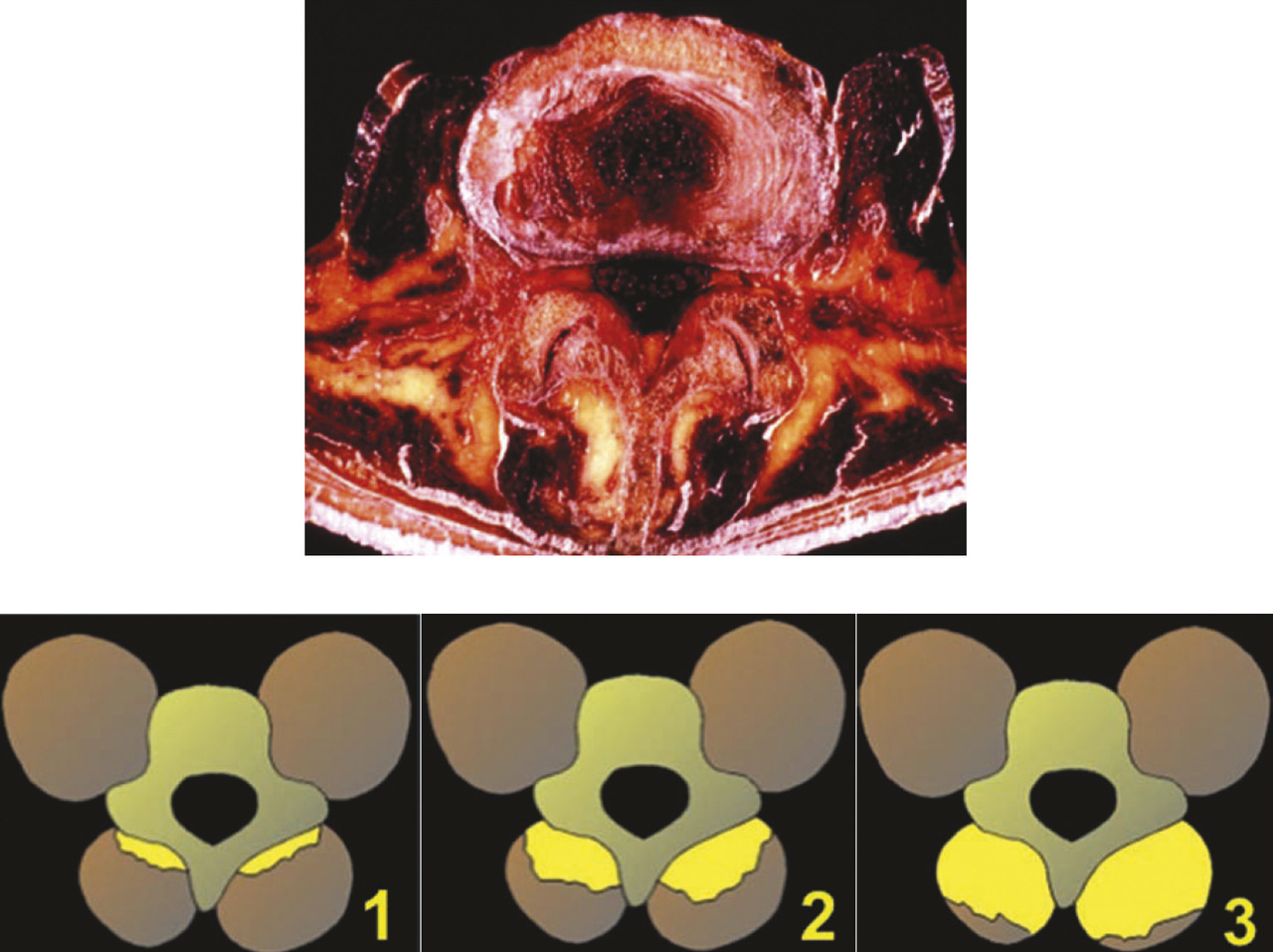
La dégénérescence ou involution graisseuse est un phénomène reconnu du vieillissement naturel des muscles ; la dégénérescence graisseuse des muscles de la masse sacro-lombaire a été décrite en trois stades (fig. 17 ) :29
– stade 1 : moins de la moitié de la surface des muscles atteinte ;
– stade 2 : 50 % de transformation graisseuse ;
– stade 3 : plus de 50 % de tissus graisseux.
Cette involution graisseuse se fait de la profondeur vers la superficie, le multifidus étant le premier muscle touché, et de bas en haut, c’est-à-dire de la charnière lombo-sacrée vers la charnière thoraco-lombaire. De plus, un lien direct a été démontré entre le vieillissement, la perte de lordose lombaire et l’importance de l’involution graisseuse musculaire des muscles paravertébraux.30
Dans une étude longitudinale en IRM sur 15 ans de l’état du multifidus, il a été noté une atrophie plus marquée en L5S1 qu’en L1L2 avec remplacement graisseux indépendant de l’activité physique (travail ou sport) mais dépendant de l’indice de masse corporelle.31
Nous avons trouvé dans la cyphose dégénérative ou arthrogénique des signes plus marqués avec disparition quasi complète des fibres de type 2, une fibroadipose majeure touchant à la fois les muscles lombaires et thoracolombaires, la présence en nombre anormal de fibres mitées, de « cores targtoïds » et de « ragged red fibers ». Tous ces signes histologiques sont observés dans les myopathies.32
L’échographie des muscles paravertébraux lombaires a permis de reconnaitre une modification de l’orientation des fibres, notamment du multifidus, allant dans le sens de la perte d’efficacité en extension.33 Cette même technique a permis d’évaluer atrophie et dégénéresence graisseuse du psoas et des érecteurs du rachis en fonction de l’équilibre sagittal : en cas d’ hypercyphose thoracique les érecteurs sont atrophiés, en cas de rétroversion du bassin, le psoas est atrophié, le tissu non-contractile du multifidus augmente.34 Grâce à l’apport de l’électromyograhie de surface des muscles paravertébraux, il a été prouvé qu’avec l’âge il y a diminution de l’endurance au test de Sorensen35, * et une diminution de la rapidité de réponse lors d’une stimulation brutale en flexion du tronc.36
Il existe donc, du fait du vieillissement, une réduction de force notamment aux membres inférieurs de 1,5 % par an à partir de 65 ans par atrophie des fibres musculaires, diminution de la puissance de 3,5 % par an par diminution des fibres de type 2 et au niveau rachidien les mêmes phénomènes avec en plus une dégénerescence graisseuse des mucles extenseurs qui touche en premier le multifidus, muscle le plus paramédian et près de la charnière lombosacrée pour s’étendre ensuite latéralement et vers le haut. Le psoas reste longtemps protégé.
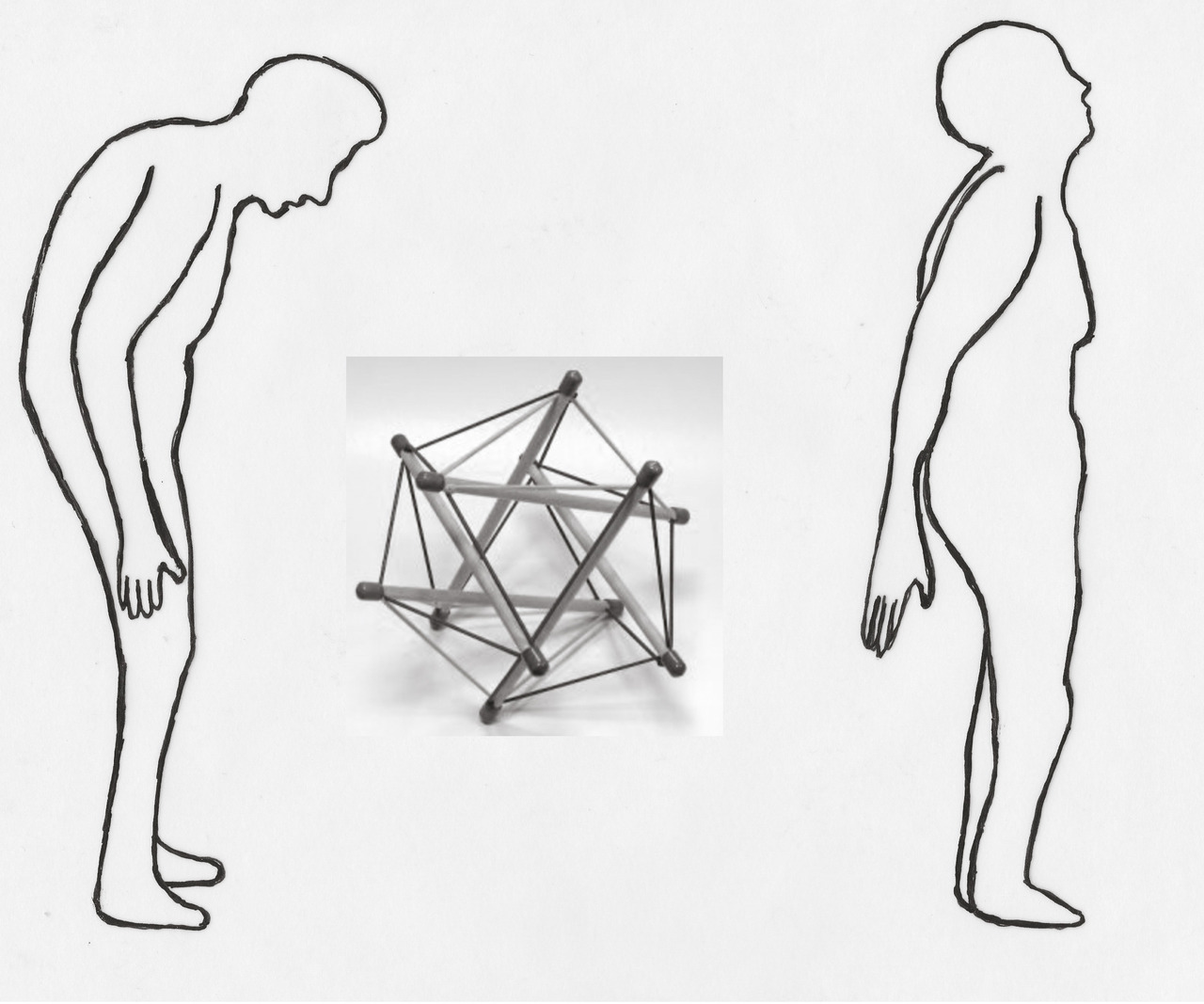
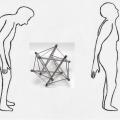
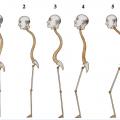
La tendance actuelle est de considérer les muscles et les structures aponévrotiques comme un ensemble faisant appel au phénomène dit de tenségrité avec maillage d’éléments de résistances différentes assurant une meilleure stabilité que chaque élément pris séparemment. Cet ensemble musculo-aponévrotique périrachidien permet au sujet âgé, souvent en déséquilibre antérieur, de se redresser et de se maintenir pendant de courts instants redressé (fig. 18 ).
La dégénérescence ou involution graisseuse est un phénomène reconnu du vieillissement naturel des muscles ; la dégénérescence graisseuse des muscles de la masse sacro-lombaire a été décrite en trois stades (
– stade 1 : moins de la moitié de la surface des muscles atteinte ;
– stade 2 : 50 % de transformation graisseuse ;
– stade 3 : plus de 50 % de tissus graisseux.
Cette involution graisseuse se fait de la profondeur vers la superficie, le multifidus étant le premier muscle touché, et de bas en haut, c’est-à-dire de la charnière lombo-sacrée vers la charnière thoraco-lombaire. De plus, un lien direct a été démontré entre le vieillissement, la perte de lordose lombaire et l’importance de l’involution graisseuse musculaire des muscles paravertébraux.30
Dans une étude longitudinale en IRM sur 15 ans de l’état du multifidus, il a été noté une atrophie plus marquée en L5S1 qu’en L1L2 avec remplacement graisseux indépendant de l’activité physique (travail ou sport) mais dépendant de l’indice de masse corporelle.31
Nous avons trouvé dans la cyphose dégénérative ou arthrogénique des signes plus marqués avec disparition quasi complète des fibres de type 2, une fibroadipose majeure touchant à la fois les muscles lombaires et thoracolombaires, la présence en nombre anormal de fibres mitées, de « cores targtoïds » et de « ragged red fibers ». Tous ces signes histologiques sont observés dans les myopathies.32
L’échographie des muscles paravertébraux lombaires a permis de reconnaitre une modification de l’orientation des fibres, notamment du multifidus, allant dans le sens de la perte d’efficacité en extension.33 Cette même technique a permis d’évaluer atrophie et dégénéresence graisseuse du psoas et des érecteurs du rachis en fonction de l’équilibre sagittal : en cas d’ hypercyphose thoracique les érecteurs sont atrophiés, en cas de rétroversion du bassin, le psoas est atrophié, le tissu non-contractile du multifidus augmente.34 Grâce à l’apport de l’électromyograhie de surface des muscles paravertébraux, il a été prouvé qu’avec l’âge il y a diminution de l’endurance au test de Sorensen35, * et une diminution de la rapidité de réponse lors d’une stimulation brutale en flexion du tronc.36
Il existe donc, du fait du vieillissement, une réduction de force notamment aux membres inférieurs de 1,5 % par an à partir de 65 ans par atrophie des fibres musculaires, diminution de la puissance de 3,5 % par an par diminution des fibres de type 2 et au niveau rachidien les mêmes phénomènes avec en plus une dégénerescence graisseuse des mucles extenseurs qui touche en premier le multifidus, muscle le plus paramédian et près de la charnière lombosacrée pour s’étendre ensuite latéralement et vers le haut. Le psoas reste longtemps protégé.
La tendance actuelle est de considérer les muscles et les structures aponévrotiques comme un ensemble faisant appel au phénomène dit de tenségrité avec maillage d’éléments de résistances différentes assurant une meilleure stabilité que chaque élément pris séparemment. Cet ensemble musculo-aponévrotique périrachidien permet au sujet âgé, souvent en déséquilibre antérieur, de se redresser et de se maintenir pendant de courts instants redressé (
Os
Pour des raisons à la fois hormonales et mécaniques, l’os perd en vieillissant de sa densité : on parle d’ostéoporose primitive sénile de type 2 par opposition à l’ostéoporose post-ménauposique de type 1 ou aux ostéoporoses secondaires.
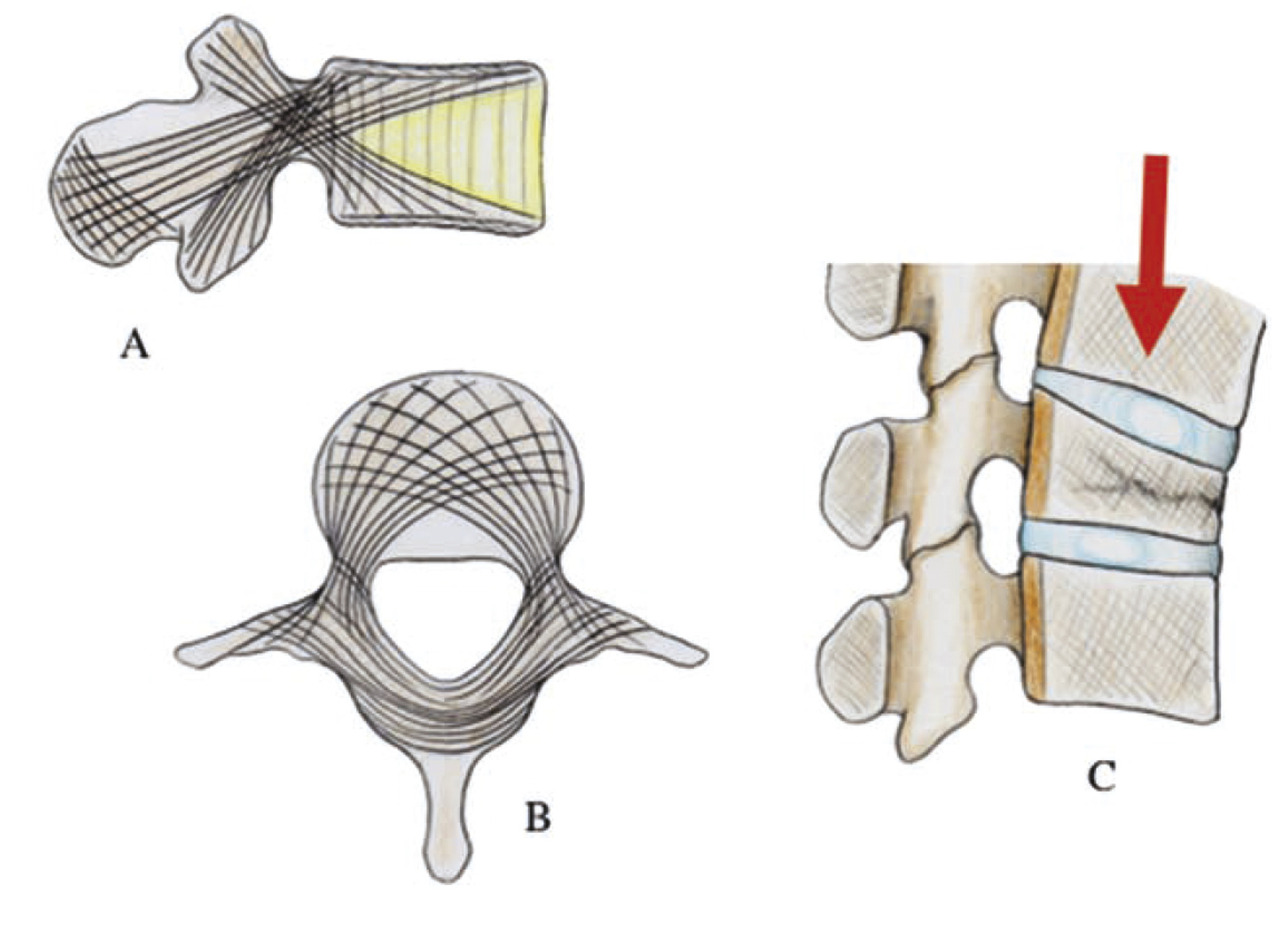
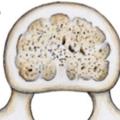
Les contraintes axiales sont encaissées an niveau de la colonne vertébrale par le disque intervertébral, les plateaux cartilagineux, d’une épaisseur de 1 à 1,5 mm permettant des échanges entre corps vertébral et disque et corps vertébraux. Ces derniers sont composés d’os spongieux entouré d’une mince couche d’os cortical. Le tissu spongieux présente une trabéculation verticale et horizontale ainsi que des travées obliques, selon les lignes de force qui sétendent : dans le plan sagittal, l’une du plateau supérieur vers la lame et les zygapophyses inférieures, l’autre des zygapophyses supérieures vers le plateau inférieur (fig. 19 ) ; dans le plan horizontal de façon circulaire autour du canal rachidien.
La résistance du corps osseux dépend de sa densité osseuse, c’est-à-dire de l’épaisseur et du nombre de travées osseuses.
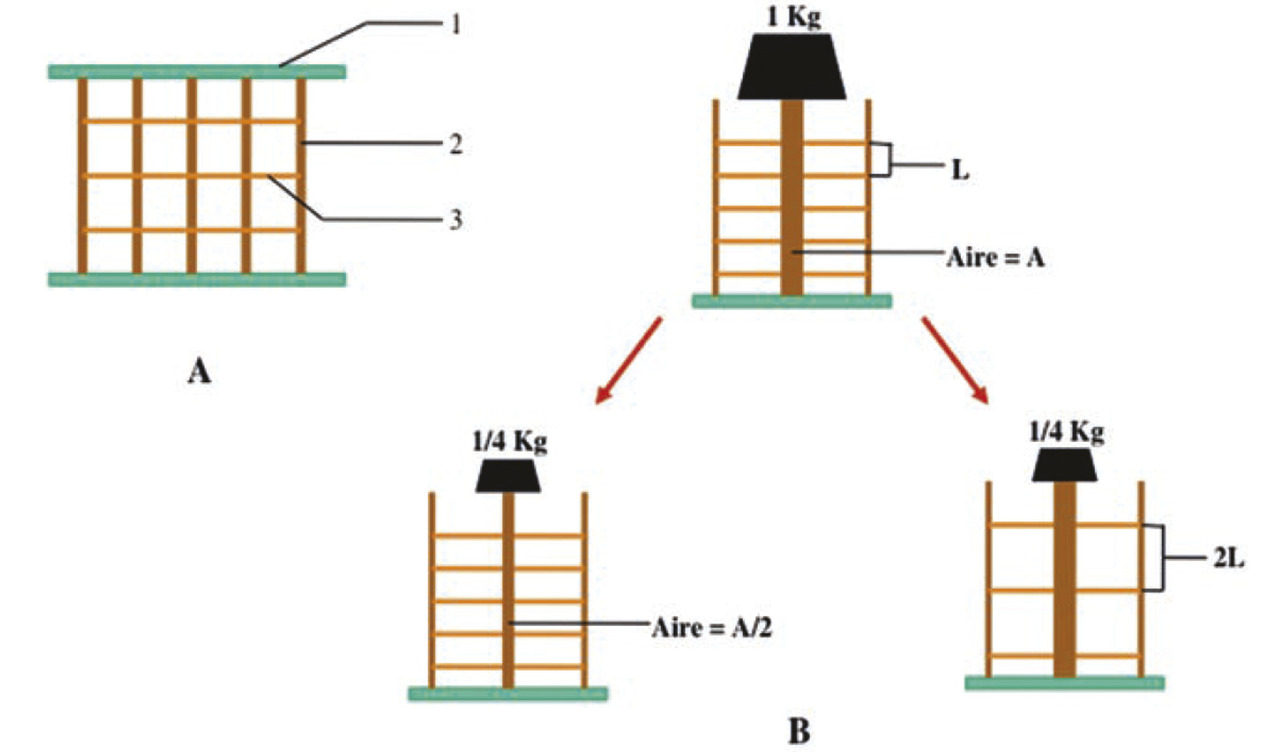
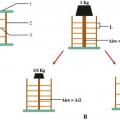
L’ostéoporose réduit l’épaisseur des travées verticales et diminue le nombre des travées horizontales, ce qui conduit à allonger les travées verticales. La résistante d’une éprouvette osseuse est proportionnelle au diamètre de la colonne et inversement proportionnelle au carré de sa longueur. Lafigure 20 montre la diminution par 4 de la résistance si la colonne verticale diminue de moitié ou s’il y a disparition d’une travée horizontale sur 2. La résistance à la compression des corps vertébraux diminue avec l’âge, particulièrement après 40 ans. Avant 40 ans, la corticale supporte 45 % des contraintes contre 55 % pour l’os spongieux ; après 40 ans, la corticale supporte 65 % des contraintes.
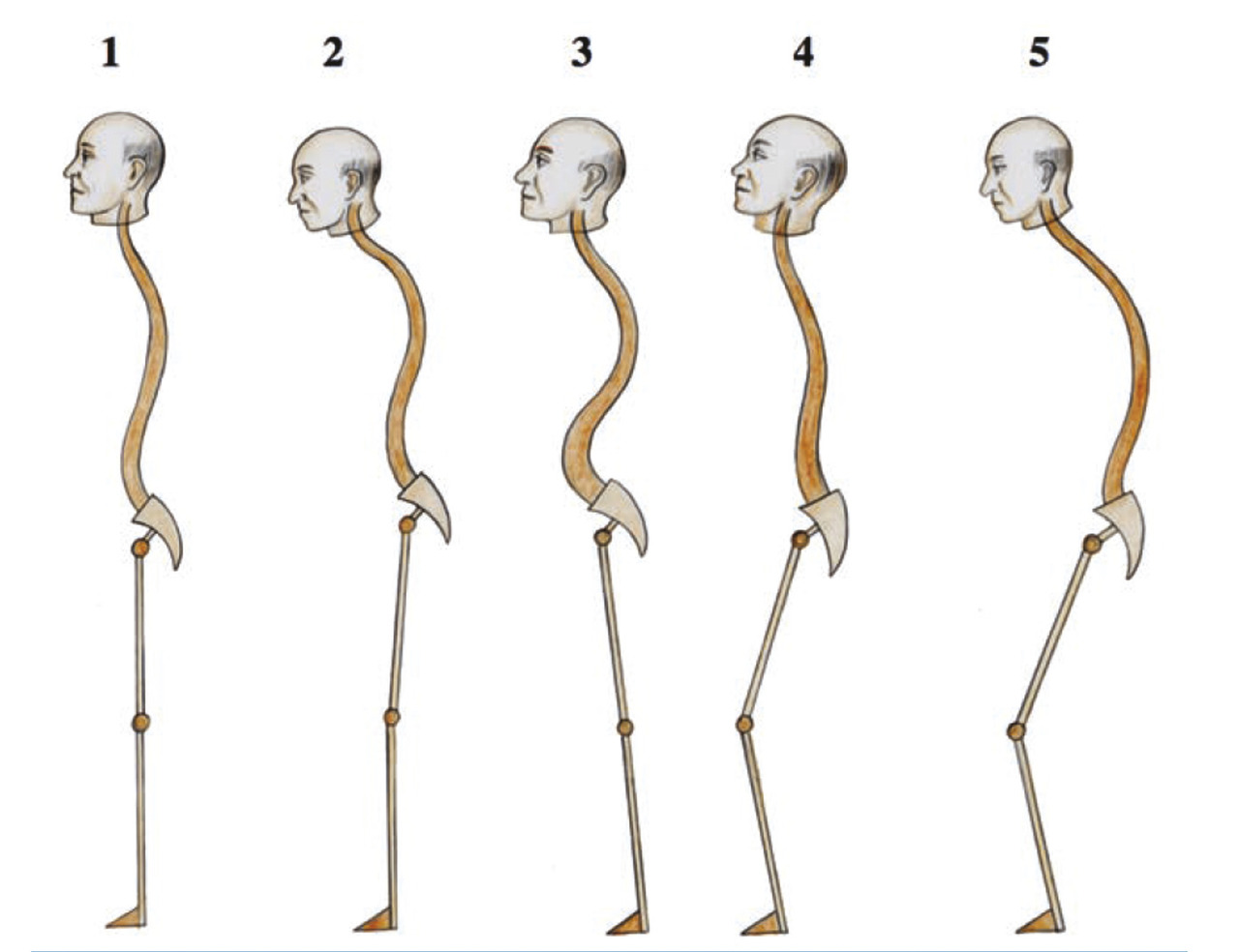
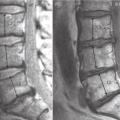
Une équipe37 a décrit en 1991 le profil de 100 sujets âgés ostéoporotiques (fig. 21 ). Les tassements lombaires et thoraco-lombaires sont les plus sévères car ils font perdre le plus de lordose. L’effet domino des tassements vertébraux, associé aux pincements discaux décrits plus haut, conduit à une perte de taille parfois de plusieurs centimètres et à un déséquilibre antérieur sévère qui peut entraîner des chutes, donc de nouvelles fractures, pour créer un véritable cercle vicieux.
Les contraintes axiales sont encaissées an niveau de la colonne vertébrale par le disque intervertébral, les plateaux cartilagineux, d’une épaisseur de 1 à 1,5 mm permettant des échanges entre corps vertébral et disque et corps vertébraux. Ces derniers sont composés d’os spongieux entouré d’une mince couche d’os cortical. Le tissu spongieux présente une trabéculation verticale et horizontale ainsi que des travées obliques, selon les lignes de force qui sétendent : dans le plan sagittal, l’une du plateau supérieur vers la lame et les zygapophyses inférieures, l’autre des zygapophyses supérieures vers le plateau inférieur (
La résistance du corps osseux dépend de sa densité osseuse, c’est-à-dire de l’épaisseur et du nombre de travées osseuses.
L’ostéoporose réduit l’épaisseur des travées verticales et diminue le nombre des travées horizontales, ce qui conduit à allonger les travées verticales. La résistante d’une éprouvette osseuse est proportionnelle au diamètre de la colonne et inversement proportionnelle au carré de sa longueur. La
Une équipe37 a décrit en 1991 le profil de 100 sujets âgés ostéoporotiques (
Contrôle neurologique de la posture
Avec le vieillissement, en dehors de toute pathologie, on observe une détérioration des mécanismes neurologiques responsables de la stabilité posturale. La fréquence et les amplitudes des oscillations posturales augmentent, avec donc une déviation plus importante de la ligne de gravité. Les fonctions visuelles, proprioceptives et vestibulaires s’altèrent. En cas de nouvelle information sensorielle, les ajustements posturaux et l’intégration des feedbacks sensoriels sont moins efficaces. Cela entraîne une rigidification de la posture et une altération de la coordination posture-mouvement. Le contrôle de la posture n’est pas seulement lié aux réflexes spinaux (tonus musculaire), à la qualité des informations sensitivo-sensorielles, mais dépend aussi des systèmes corticaux et sous-corticaux impliqués dans le contrôle moteur et l’intégration des informations sensitivo-sensorielles. Le vieillissement nécessite une réorganisation du contrôle cortical et spinal de la posture. Le sujet va, avec l’âge, compenser par des stratégies neurologiques et mécaniques.
Proprioception
La sensibilité épicritique (tact et proprioception) donne des informations importantes pour le maintien postural et les réajustements nécessaires, que le sujet soit mobile ou immobile. De nombreux facteurs interviennent dans le vieillissement proprioceptif :38 diminution des fibres intrafusoriales, modification des fibres musculaires surtout aux dépens des fibres de type 2, réduction du nombre des récepteurs aux niveaux musculaire, tendineux, articulaire et cutané, et particulièrement au niveau de la voûte plantaire ; modification structurale des fibres nerveuses périphériques (réduction de la myéline) surtout distales, et en particulier sensitives, avec allongement des temps de conduction nerveuse ; à l’examen, les réflexes ostéotendineux sont diminués ou abolis (achiléens abolis chez plus d’un tiers des sujets de plus de 70 ans). La sensibilité plantaire diminue surtout après la 7e décennie. La morphologie des récepteurs change, leur densité diminue, l’élasticité de la peau glabre et la conduction nerveuse diminuent. Les afférences épicritiques des voûtes plantaires constituent un rétrocontrôle important pour le contrôle postural en orthostatisme bien plus qu’à la marche.39 La densité des récepteurs au niveau des muscles cervicaux, surtout au niveau des muscles sous-occipitaux, est très supérieure à la majeure partie des autres muscles de l’organisme. Avec l’âge, la raideur axiale entraîne une sous-utilisation du système oculocéphalogyre et une perte de la dissociation tête-tronc. Les limitations articulaires et les douleurs entraînent une déficience des informations proprioceptives, et des informations aberrantes sont données aux vestibules.40 Malgré son implication dans les troubles de la posture liés à l’âge, et le corollaire qu’est la chute, l’évaluation clinique de la proprioception reste limitée au cours de la vie. Plusieurs pistes ont néanmoins été proposées pour améliorer le contrôle de la posture. L’altération des fibres de type 2 est partiellement réversible avec l’exercice. Le travail postural (études sur le tai-chi) améliore les capacités proprioceptives chez le sujet âgé. L’« apprentissage proprioceptif » doit se faire conjointement avec le travail cognitif.41 Le maintien de la station unipodale est un indicateur prédictif de la chute connu depuis longtemps. À la marche, il y a un déficit de hauteur et de longueur du pas. Les chevilles sont moins sollicitées avec l’âge, les stratégies d’équilibration s’organisent au niveau des hanches.
Vision et contrôle visuomoteur
Après 50 ans, on observe une diminution de l’acuité visuelle, de la sensibilité aux contrastes, de l’adaptation à l’obscurité, de l’accommodation, de la perception des reliefs, de l’appréciation des distances.42 En orthostatisme, le corps oscille au niveau des chevilles en fonction des déplacements du champ visuel, et l’aire des oscillations posturales augmente de 30 % debout les yeux fermés.38 Les oscillations augmentent avec l’âge car il y a une plus mauvaise intégration et interprétation des informations visuospatiales.
Vestibule
En dehors de toute pathologie, dès 50 ans, on observe une diminution des cellules sensorielles au niveau des systèmes otolithique et canalaire, ainsi qu’une diminution des fibres myélinisées venant des vestibules. Plus d’un tiers des individus après 70 ans ont un trouble vestibulaire de façon bilatérale sans symptôme déclaré d’instabilité.43 Il est observé une plus grande difficulté à intégrer les mouvements rotatoires, liée à une altération de la voie vestibulospinale latérale qui contrôle les extenseurs du rachis thoracolombaire, avec donc des répercussions sur la morphologie du rachis lombaire.
Intégration centrale
Toutes les structures du système nerveux central interviennent dans le contrôle postural : le tonus des muscles extenseurs par les afférences vestibulaires, réticulaires, tectales et olivaires, la perception de la ligne verticale (dans les plans sagittal et frontal) par les afférences vestibulaires, thalamiques et corticales, la stabilisation posturale grâce aux synergies musculaires (noyaux gris centraux) et à la coordination musculaire (cervelet). Les circuits corticaux interviennent à plusieurs niveaux dans le contrôle de la posture :
– le contrôle moteur ;
– l’interaction entre les informations sensitivosensorielles et leur intégration au niveau du cortex associatif postérieur. La reprogrammation sensorimotrice vise à apprendre au sujet âgé à utiliser une entrée sensorielle que préalablement il n’utilisait pas préférentiellement. La dégradation avec l’âge de la qualité de tous les messages sensoriels peut aboutir à une véritable déafférentation ;44
– les fonctions cognitives, par le lobe préfrontal notamment, telles la capacité attentionnelle, les comportements de stratégie, et les processus mnésiques.
Des études en IRM fonctionnelle ont montré que l’activation du putamen est corrélée à la capacité proprioceptive et qu’il y a une diminution de cette activation corrélée à l’âge.
Le contrôle sensorimoteur de la posture est hiérarchisé, peu d’attention est nécessaire, sauf chez le sujet âgé chez qui on observe une diminution de la qualité des informations et de leur intégration, une diminution du contrôle des mouvements automatiques, d’où une attention nécessaire plus importante.45
Le maintien de la posture debout chez le sujet âgé interagit négativement avec sa capacité à réaliser une deuxième tâche.46 La détérioration de la motricité holocinétique impose donc une participation corticale plus importante. Par exemple, le sujet s’arrête de marcher quand il parle. Les muscles travaillent en synergie pour le maintien de la posture au niveau du tronc et des membres inférieurs, au niveau de la nuque et des membres supérieurs. Les synergies musculaires sont des schémas d’activation musculaire avec des caractéristiques spatiotemporelles reproductibles, stables, dont le niveau et la latence d’activation sont modifiés en fonction des informations somatosensorielles, permettant les ajustements posturaux.
Tous ces ajustements sont altérés par le défaut d’informations neurologiques (v. supra) auquel s’ajoute la compression arthrosique des canaux lombaire ou cervical étroits.
– le contrôle moteur ;
– l’interaction entre les informations sensitivosensorielles et leur intégration au niveau du cortex associatif postérieur. La reprogrammation sensorimotrice vise à apprendre au sujet âgé à utiliser une entrée sensorielle que préalablement il n’utilisait pas préférentiellement. La dégradation avec l’âge de la qualité de tous les messages sensoriels peut aboutir à une véritable déafférentation ;44
– les fonctions cognitives, par le lobe préfrontal notamment, telles la capacité attentionnelle, les comportements de stratégie, et les processus mnésiques.
Des études en IRM fonctionnelle ont montré que l’activation du putamen est corrélée à la capacité proprioceptive et qu’il y a une diminution de cette activation corrélée à l’âge.
Le contrôle sensorimoteur de la posture est hiérarchisé, peu d’attention est nécessaire, sauf chez le sujet âgé chez qui on observe une diminution de la qualité des informations et de leur intégration, une diminution du contrôle des mouvements automatiques, d’où une attention nécessaire plus importante.45
Le maintien de la posture debout chez le sujet âgé interagit négativement avec sa capacité à réaliser une deuxième tâche.46 La détérioration de la motricité holocinétique impose donc une participation corticale plus importante. Par exemple, le sujet s’arrête de marcher quand il parle. Les muscles travaillent en synergie pour le maintien de la posture au niveau du tronc et des membres inférieurs, au niveau de la nuque et des membres supérieurs. Les synergies musculaires sont des schémas d’activation musculaire avec des caractéristiques spatiotemporelles reproductibles, stables, dont le niveau et la latence d’activation sont modifiés en fonction des informations somatosensorielles, permettant les ajustements posturaux.
Tous ces ajustements sont altérés par le défaut d’informations neurologiques (v. supra) auquel s’ajoute la compression arthrosique des canaux lombaire ou cervical étroits.
* Test qui permet une évaluation rapide, simple et reproductible de l’endurance isométrique des muscles extenseurs du tronc.
Références
1. Kirkaldy-Wills WH, Farfan HF. Instability of the lumbar spine. Clin Orthop Relat Res 1982;165:110-23.
2. Roberts S, Evans H, Trivedi J, Menage J. Histology and pathology of the human intervertebral disc. J Bone Joint Surg 2006;88A(suppl 2):10-4.
3. Urban JPG, Smith S, Fairbank JCT. Nutrition of the intervertebral disc. Spine 2004;29:2700-9.
4. Battie MC, Videman T. Lumbar disc degeneration: epidemiology and genetics. J Bone Joint Surg 2006;88A(suppl 2):3-9.
5. Sambrook PN, Macgregor AJ, Spector TD. Genetic influences on cervical and lumbar disc degeneration: a magnetic resonance imaging study in twins. Arthritis Rheum 1999;42:366-72.
6. Matsumoto M, Okada E, Ichihara D, et al. Age-related changes of thoracic and cervical intervertebral discs in asymptomatic subjects. Spine 2010;35:1359-64.
7. Vernon-Roberts B, Moore RJ, Fraser RD. The natural history of age-related disc degeneration: the influence of age and pathology on cell populations in the L4-L5 disc. Spine 2008;33:2767-73.
8. Gruber HE, Hanley EN Jr. Analysis of aging and degeneration of the human intervertebral disc. Comparison of surgical specimens with normal controls. Spine 1998;23:751-7.
9. Weiler C, Schietzsch M, Kirchner T, Nerlich AG, Boos N, Wuertz K. Age-related changes in human cervical, thoracal and lumbar intervertebral disc exhibit a strong intra-individual correlation. Eur Spine J 2012;21(Suppl 6):810-8.
10. Haeffeli M, Kalberer F, Saegesser D, Nerlich AG, Boos N, Paesold G. The course of macroscopic degeneration in the human lumbar intervertebral. Spine 2006;14:1522-31.
11. Pfirmann CWA, Metzdorf A, Zanetti M, et al. Magnetic resonance classification of lumbar intervertebral disc degeneration. Spine 2001;26:1873-8.
12. Modic M, Masaryk TJ, Ross JS, Carter JR. Imaging of the degenerative disc discase. Radiology 1988;168:177-86.
13. Stokes IAF, Iatridis JC. Mechanical conditions that accelerate intervertebral disc degeneration : overload versus immobilization. Spine 2004;29:2224-32.
14. Hutton WC, Elmer WA, Hyon S, et al. The effect of hydrostatic pressure on intervertebral disc metabolism. Spine 1999;24:1507-15.
15. Handa T, Ishihara H, Ohshima H, Osada R, Tsuji H, Obata K. Effects of hydrostatic pressure on matrix synthesis and matrix metalloproteinase production in the human lumbar intervertebral disc. Spine 1997;22:1085-91.
16. Rannou F, Mayoux-Benhamou MA, Poiraudeau S, Revel M. Disque intervertébral et structures voisines de la colonne lombaire: anatomie, biologie, physiologie et biomécanique. EMC Chirg App Locom 2004;15-480.A.10.
17. Kauppila LI, Pentilla A, Karnunen PJ, Lalu K, Hannikainen P. Lumbar disc degeneration and arthosclerosis of abdominal aorta. Spine 1994;8:923-9.
18. Zhang Z, Chan Q, Anthony MP, et al. Age-related diffusion patterns in human lumbar intervertebral discs: a pilot study in asymptomaticsubjects. Magn Reson Imaging 2012;30:181-8.
19. Brinjikji W, Diehn FE, Jarvik JG, et al. MRI findings of disc degeneration are more prevalent in adults with low back pain than in asymptomatic controls: a systematic review and meta-analysis. Am J Neuroradiol 2015;36:2394-9.
20. Pollintine P, van Tunen MS, Luo J, Brown MD, Dolan P, Adams MA. Time-dependent compressive deformation of the ageing spine: relevance to spinal stenosis. Spine 2010;35:386-94.
21. Videman T, Battié MC, Gibbons LE, Gill K. Aging changes in lumbar discs and vertebrae and their interaction: a 15-year follow-up study. Spine J 2014;14:469-78.
22. Okada E, Matsumoto M, Ichihara D, et al. Does the sagittal alignment of the cervical spine have an impact on disk degeneration? Minimum 10-year follow-up of asymptomatic volunteers. Eur Spine J 2009;18:1644-51.
23. Okada E, Matsumoto M, Ichihara D, et al. Aging of the cervical spine in healthy volunteers: a 10-year longitudinal magnetic resonance imaging study. Spine 2009;34:706-12.
24. Matsumoto M1, Okada E, Ichihara D, et al. Age-related changes of thoracic and cervical intervertebral discs in asymptomatic subjects. Spine 2010;35:1359-64.
25. Weishaupt D, Zanetti M, Boos N, Hodler J. MR Imaging and CT in osteoarthritis of the lumbar facet joints. Skeletal Radiol 1999;28:215-9.
26. Wang J, Yang X. Age-related changes in the orientation of lumbar facet joints. Spine 2009;34:E596-E598.
27. Grogan J, Nowicki BH, Schmidt TA et al. Lumbar fact joint tropism does not accelerate degeneration of the facet joints. Am J Neuroradiol 1997;18:1325-9.
28. Aylott CEW, Puna R, Robertson PA, Walker C. Spinous process morphology : the effect of ageing through adulthood on spinous process size and relationship to sagittal balance. Eur Spine J 2012;21:1007-12.
29. Hadar H, Gadoth N, Heifetz M. Fatty replacement of lower paraspinal muscles: normal and neuromuscular disorders. Am J Neuro Radiol 1983;141:895-8.
30. Cruz-Jentoft AJ, Baeyens JP, Bauer JM, et al. Sarcopenia : European consensus on definition and diagnosis : report of the European working group on sarcopenia in older people. Age Ageing 2010;39:412-23.
31. Fortin M, Videman T, Gibbons LE, Battie M. Paraspinal muscle morphology and composition : a 15-yr longitudinal magnetic resoance imaging study. Med Sci Sport Exerc 2014; 893-901.
32. Vital JM, Gille O, Coquet M. Déformations rachidiennes : anatomopathologie et histoenzymologie. Rev Rhum 2004;71:263-4.
33. Singh DKA, Bailey M, Lee RYW. Ageing modifies the fibre angle and biomechanical function of the lumbar extensor muscles. Clin Biomech 2011;26:543-7.
34. Mazaki M, Ikezoe T, Fukumoto Y, et al. Association of sagittal spinal alignment with thickness and echo intensity of lumbar back muscles in middle-aged and elderly women Arch Gerontol Geriatr 2015;61:197-201.
35. Tsuboi H, Nishimura Y, Sakata T, et al. Age-related sex differences in erector spinae muscle endurance using surface electromyographic power spectral analysis in healthy humans. Spine J 2013;13:1928-33.
36. Hwang JH, Lee YT, Park DS, Kwon TK. Age affects the latency of the erector spinae reponse to sudden loading. Clin Biomech 2008;23:23-9.
37. Itoi E. Roentenographic analysis of posture in spinal osteoporotics. Spine 1991;16:750-6.
38. Sturnieks DL, St George R, Lord SR. Balance disorders in the elderly. Neurophysiol Clin 2008;38:467-78.
39. Zhang S, Li L. The differential effects of foot sole sensory on plantar pressure distribution between balance and gait. Gait Posture 2013;37:532-5.
40. Gosselin G, Rassoulian H, Brown I. Effects of neck extensor muscles fatigue on balance. Clin Biomech 2004;19:473-9.
41. Suetterlin KJ, Sayer AA. Proprioception : where are we now ? A commentary on clinical assessment, changes across the life course, functional implications and future interventions. Age Ageing 2014;43:313-8.
42. Owsley C. Aging and vision. Vision Res 2011;51:1610-22.
43. Iwasaki S, Yamasoba T. Dizziness and imbalance in the elderly : age-related decline in the vestibular system. Aging Dis 2015;6:38-47.
44. Manckoudia P , Mourey F, Tavernier-Vidal B, Pfitzenmeyer P. Syndrome de désadaptation psychomotrice. Rev Med Int 2007;28:79-85.
45. Shumway-Cook A, Woollacott M. Attentional demands and postural control : the effect of sensory context. J Gerontol 2000;55A:M10-M16.
46. Huxhold O, Li SC, Schmiedek F, Lindenberger U. Dual-tasking postural control : aging and the effects of cognitive demand in conjunction with focus of attention. Brain Res Bull 2006;69:294-305.
2. Roberts S, Evans H, Trivedi J, Menage J. Histology and pathology of the human intervertebral disc. J Bone Joint Surg 2006;88A(suppl 2):10-4.
3. Urban JPG, Smith S, Fairbank JCT. Nutrition of the intervertebral disc. Spine 2004;29:2700-9.
4. Battie MC, Videman T. Lumbar disc degeneration: epidemiology and genetics. J Bone Joint Surg 2006;88A(suppl 2):3-9.
5. Sambrook PN, Macgregor AJ, Spector TD. Genetic influences on cervical and lumbar disc degeneration: a magnetic resonance imaging study in twins. Arthritis Rheum 1999;42:366-72.
6. Matsumoto M, Okada E, Ichihara D, et al. Age-related changes of thoracic and cervical intervertebral discs in asymptomatic subjects. Spine 2010;35:1359-64.
7. Vernon-Roberts B, Moore RJ, Fraser RD. The natural history of age-related disc degeneration: the influence of age and pathology on cell populations in the L4-L5 disc. Spine 2008;33:2767-73.
8. Gruber HE, Hanley EN Jr. Analysis of aging and degeneration of the human intervertebral disc. Comparison of surgical specimens with normal controls. Spine 1998;23:751-7.
9. Weiler C, Schietzsch M, Kirchner T, Nerlich AG, Boos N, Wuertz K. Age-related changes in human cervical, thoracal and lumbar intervertebral disc exhibit a strong intra-individual correlation. Eur Spine J 2012;21(Suppl 6):810-8.
10. Haeffeli M, Kalberer F, Saegesser D, Nerlich AG, Boos N, Paesold G. The course of macroscopic degeneration in the human lumbar intervertebral. Spine 2006;14:1522-31.
11. Pfirmann CWA, Metzdorf A, Zanetti M, et al. Magnetic resonance classification of lumbar intervertebral disc degeneration. Spine 2001;26:1873-8.
12. Modic M, Masaryk TJ, Ross JS, Carter JR. Imaging of the degenerative disc discase. Radiology 1988;168:177-86.
13. Stokes IAF, Iatridis JC. Mechanical conditions that accelerate intervertebral disc degeneration : overload versus immobilization. Spine 2004;29:2224-32.
14. Hutton WC, Elmer WA, Hyon S, et al. The effect of hydrostatic pressure on intervertebral disc metabolism. Spine 1999;24:1507-15.
15. Handa T, Ishihara H, Ohshima H, Osada R, Tsuji H, Obata K. Effects of hydrostatic pressure on matrix synthesis and matrix metalloproteinase production in the human lumbar intervertebral disc. Spine 1997;22:1085-91.
16. Rannou F, Mayoux-Benhamou MA, Poiraudeau S, Revel M. Disque intervertébral et structures voisines de la colonne lombaire: anatomie, biologie, physiologie et biomécanique. EMC Chirg App Locom 2004;15-480.A.10.
17. Kauppila LI, Pentilla A, Karnunen PJ, Lalu K, Hannikainen P. Lumbar disc degeneration and arthosclerosis of abdominal aorta. Spine 1994;8:923-9.
18. Zhang Z, Chan Q, Anthony MP, et al. Age-related diffusion patterns in human lumbar intervertebral discs: a pilot study in asymptomaticsubjects. Magn Reson Imaging 2012;30:181-8.
19. Brinjikji W, Diehn FE, Jarvik JG, et al. MRI findings of disc degeneration are more prevalent in adults with low back pain than in asymptomatic controls: a systematic review and meta-analysis. Am J Neuroradiol 2015;36:2394-9.
20. Pollintine P, van Tunen MS, Luo J, Brown MD, Dolan P, Adams MA. Time-dependent compressive deformation of the ageing spine: relevance to spinal stenosis. Spine 2010;35:386-94.
21. Videman T, Battié MC, Gibbons LE, Gill K. Aging changes in lumbar discs and vertebrae and their interaction: a 15-year follow-up study. Spine J 2014;14:469-78.
22. Okada E, Matsumoto M, Ichihara D, et al. Does the sagittal alignment of the cervical spine have an impact on disk degeneration? Minimum 10-year follow-up of asymptomatic volunteers. Eur Spine J 2009;18:1644-51.
23. Okada E, Matsumoto M, Ichihara D, et al. Aging of the cervical spine in healthy volunteers: a 10-year longitudinal magnetic resonance imaging study. Spine 2009;34:706-12.
24. Matsumoto M1, Okada E, Ichihara D, et al. Age-related changes of thoracic and cervical intervertebral discs in asymptomatic subjects. Spine 2010;35:1359-64.
25. Weishaupt D, Zanetti M, Boos N, Hodler J. MR Imaging and CT in osteoarthritis of the lumbar facet joints. Skeletal Radiol 1999;28:215-9.
26. Wang J, Yang X. Age-related changes in the orientation of lumbar facet joints. Spine 2009;34:E596-E598.
27. Grogan J, Nowicki BH, Schmidt TA et al. Lumbar fact joint tropism does not accelerate degeneration of the facet joints. Am J Neuroradiol 1997;18:1325-9.
28. Aylott CEW, Puna R, Robertson PA, Walker C. Spinous process morphology : the effect of ageing through adulthood on spinous process size and relationship to sagittal balance. Eur Spine J 2012;21:1007-12.
29. Hadar H, Gadoth N, Heifetz M. Fatty replacement of lower paraspinal muscles: normal and neuromuscular disorders. Am J Neuro Radiol 1983;141:895-8.
30. Cruz-Jentoft AJ, Baeyens JP, Bauer JM, et al. Sarcopenia : European consensus on definition and diagnosis : report of the European working group on sarcopenia in older people. Age Ageing 2010;39:412-23.
31. Fortin M, Videman T, Gibbons LE, Battie M. Paraspinal muscle morphology and composition : a 15-yr longitudinal magnetic resoance imaging study. Med Sci Sport Exerc 2014; 893-901.
32. Vital JM, Gille O, Coquet M. Déformations rachidiennes : anatomopathologie et histoenzymologie. Rev Rhum 2004;71:263-4.
33. Singh DKA, Bailey M, Lee RYW. Ageing modifies the fibre angle and biomechanical function of the lumbar extensor muscles. Clin Biomech 2011;26:543-7.
34. Mazaki M, Ikezoe T, Fukumoto Y, et al. Association of sagittal spinal alignment with thickness and echo intensity of lumbar back muscles in middle-aged and elderly women Arch Gerontol Geriatr 2015;61:197-201.
35. Tsuboi H, Nishimura Y, Sakata T, et al. Age-related sex differences in erector spinae muscle endurance using surface electromyographic power spectral analysis in healthy humans. Spine J 2013;13:1928-33.
36. Hwang JH, Lee YT, Park DS, Kwon TK. Age affects the latency of the erector spinae reponse to sudden loading. Clin Biomech 2008;23:23-9.
37. Itoi E. Roentenographic analysis of posture in spinal osteoporotics. Spine 1991;16:750-6.
38. Sturnieks DL, St George R, Lord SR. Balance disorders in the elderly. Neurophysiol Clin 2008;38:467-78.
39. Zhang S, Li L. The differential effects of foot sole sensory on plantar pressure distribution between balance and gait. Gait Posture 2013;37:532-5.
40. Gosselin G, Rassoulian H, Brown I. Effects of neck extensor muscles fatigue on balance. Clin Biomech 2004;19:473-9.
41. Suetterlin KJ, Sayer AA. Proprioception : where are we now ? A commentary on clinical assessment, changes across the life course, functional implications and future interventions. Age Ageing 2014;43:313-8.
42. Owsley C. Aging and vision. Vision Res 2011;51:1610-22.
43. Iwasaki S, Yamasoba T. Dizziness and imbalance in the elderly : age-related decline in the vestibular system. Aging Dis 2015;6:38-47.
44. Manckoudia P , Mourey F, Tavernier-Vidal B, Pfitzenmeyer P. Syndrome de désadaptation psychomotrice. Rev Med Int 2007;28:79-85.
45. Shumway-Cook A, Woollacott M. Attentional demands and postural control : the effect of sensory context. J Gerontol 2000;55A:M10-M16.
46. Huxhold O, Li SC, Schmiedek F, Lindenberger U. Dual-tasking postural control : aging and the effects of cognitive demand in conjunction with focus of attention. Brain Res Bull 2006;69:294-305.