L’émergence des outils technologiques dans le paysage diabétologique s’inscrit dans une large mutation numérique de la prise en charge des patients atteints de diabète. La télémédecine et les algorithmes sont déjà intégrés dans la pratique de routine du diabétologue et seront complétés demain par l’arrivée de l’intelligence artificielle.
La télémédecine en diabétologie
La principale particularité de la diabétologie moderne est d’utiliser des outils de suivi et/ou des outils thérapeutiques qui sont de plus en plus « connectés ». En effet, qu’il s’agisse des lecteurs de glycémie capillaire, des capteurs de glucose interstitiel ou des pompes à insuline, la grande majorité de ces systèmes possèdent des modules bluetooth ou NFC (near-field communication) qui permettent une remontée automatisée ou semi-automatisée des données de glucose et d’insuline vers des plateformes de suivi via une application embarquée sur le smartphone du patient.1 Depuis peu, des stylos à insuline également « connectés » viennent compléter l’arsenal des dispositifs technologiques du diabète. Il s’agit de stylos réutilisables, intégrant une technologie « connectée » ou de capuchons « connectés » qui viennent se placer sur le bouton de sélection de dose de stylos jetables.2
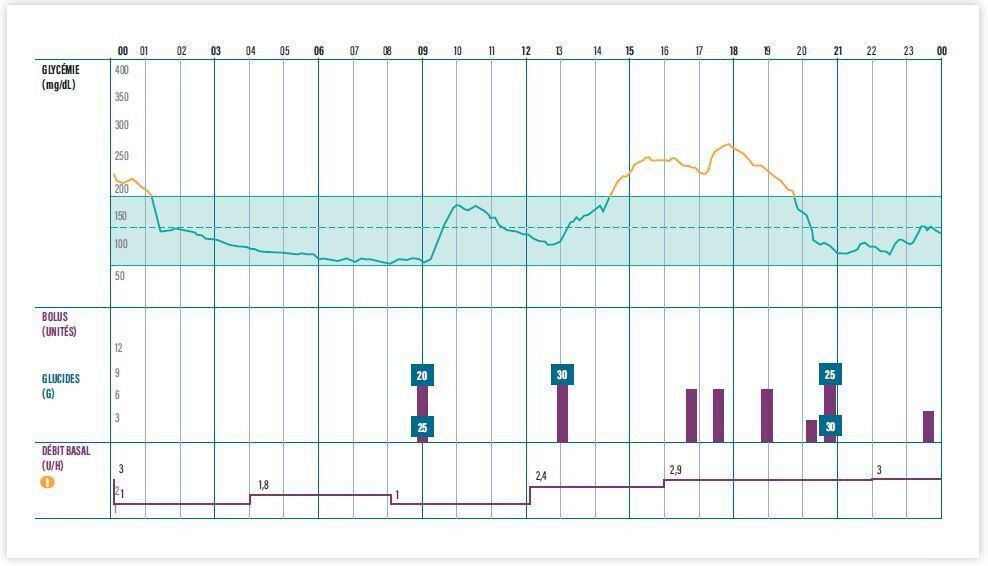
Les données générées par ces différents systèmes implémentent des plateformes de suivi des patients. Certaines plateformes sont dites « propriétaires », c’est-à-dire qu’elles sont reliées exclusivement à un dispositif, mais de plus en plus de plateformes sont dites « interopérables », c’est-à-dire qu’elles sont capables de récupérer des données issues de nombreux dispositifs différents, quel que soit leur type ou constructeur. Les plateformes interopérables (par exemple MyDiabby®, Glooko®, GlookoXT®, Tidepool®…) présentent un grand nombre de compatibilités et sont capables de présenter sur un rapport unique les données d’un capteur (par exemple Dexcom G6®, Abbott FreeStyle Libre®…) parallèlement aux données d’insuline d’une pompe (par exemple Omnipod ®, Tandem®, YpsoPump®…) ou encore d’un stylo connecté (par exemple NovoPen6®, TempoPen®…). Ces plateformes peuvent également intégrer des données concernant les prises alimentaires déclarées par les patients (via l’assistant bolus de la pompe ou d’une application partenaire), ainsi que des éléments concernant l’activité physique (podomètre et/ou accéléromètre du smartphone ou de la montre connectée) [figure]. La concentration de l’ensemble des données de surveillance (capteur de glucose), de traitement (doses d’insuline) et d’hygiène de vie (quantités de glucide ingérées, activité physique) sur un rapport unique facilite bien sûr l’analyse de la situation par les professionnels du diabète et constitue un document propice à un échange éducatif riche avec le patient. L’hébergement de ces plateformes sur un cloud permet également une pratique télémédicale facilitée, l’ensemble des éléments d’analyse étant disponible à distance et le plus souvent en temps réel.3
C’est précisément grâce à l’émergence des outils connectés et des plateformes de suivi qu’ont pu se développer, en diabétologie, la télésurveillance et les téléconsultations, principalement depuis 2018. La télésurveillance, dont le cadre réglementaire a longtemps été expérimental (programme national ETAPES), a rejoint la téléconsultation dans le cadre du droit commun depuis le 1er juillet 2023.4 La télésurveillance concerne les patients atteints de diabète de type 1 (DT1) et les patients atteints de diabète de type 2 (DT2) sous insuline. Elle a pour but l’optimisation de l’équilibre glycémique de ces patients grâce à un suivi télémédical rapproché via une plateforme colligeant les données de suivi glycémique et les données thérapeutiques (stylos connectés ou pompe à insuline). En plus d’une amélioration métabolique déjà prouvée dans de nombreuses études,5 la télémédecine en diabétologie pourrait théoriquement faciliter l’accès aux soins des patients atteints de diabète, dans un contexte démographique médical difficile dans de nombreuses régions françaises.
Les systèmes de délivrance automatisée de l’insuline
Le développement des capteurs de glucose interstitiel, débuté il y a une vingtaine d’années, s’est accompagné d’une recherche active sur les systèmes de délivrance automatisée de l’insuline. Ces systèmes, encore appelés « boucle fermée » (BF), sont composés d’un capteur de glucose interstitiel qui mesure en temps réel le taux de glucose, d’une pompe qui permet une infusion continue de l’insuline, et d’un algorithme qui s’interface entre ces deux dispositifs, afin d’adapter les débits d’insuline pour maintenir le taux de glucose le plus proche possible de la zone physiologique. Ce concept simple a nécessité plus de deux décennies de recherche avant d’arriver à maturité, les premiers dispositifs de routine étant disponibles depuis le début des années 2020. Tous les dispositifs utilisés actuellement sont des BF dites « hybrides », l’annonce des repas et de l’activité physique restant à la charge du patient. Ces systèmes sont actuellement uniquement indiqués pour les patients atteints de DT1 et ont largement prouvé leur efficacité dans de nombreuses études prospectives et dans des observatoires de routine.6 - 10 La mise en place d’un tel système est associée à une amélioration moyenne de + 10 % de temps passé dans la zone cible (time in range [TIR] de 70 - 180 mg/dL), de - 8,5 % de temps passé en hyperglycémie (time above range [TAR] de 180 mg/dL) et de - 1,5 % de temps passé en hypoglycémie (time below range [TBR] de 70 mg/dL).6 Les cohortes récentes de « vraie vie » rapportent que 60 à 75 % des utilisateurs de BF ont un TIR > 70 %.8,9
La BF est désormais le traitement de référence du DT1, selon plusieurs recommandations nationales et internationales, aussi bien chez l’adulte que chez l’enfant au-delà de 6 ans, le niveau de preuve étant un peu moins fort chez les enfants ≤ 6 ans.11,14 De nombreuses études sont en cours afin d’explorer ou confirmer l’intérêt de la BF pour des populations particulières : femmes enceintes, jeunes enfants, sujets âgés, diabètes secondaires à une pancréatopathie, patients ayant subi une chirurgie pancréatique et sujets atteints de DT2.13 Concernant les patients DT2, les premières études réalisées chez des patients hospitalisés ou chez des patients ambulatoires ont montré des résultats concordants et très favorables, le TIR s’améliorant de + 30 % environ grâce à la BF, comparativement à une insulinothérapie conventionnelle, sans majoration du risque hypoglycémique.15,16 Dans la population des patients DT2, du fait d’une variabilité post-prandiale moindre que chez les patients DT1, il faut souligner que la BF n’est plus « hybride » mais « totalement fermée », les patients n’ayant notamment pas besoin d’intervenir manuellement avant les repas.
Des améliorations sont en développement sur les systèmes de boucle fermée, en particulier pour aboutir à la boucle « totalement fermée », également pour les patients DT1. Dans ce but, différentes approches sont expérimentées, avec des systèmes bi-hormonaux (insuline + glucagon ou insuline + pramlintide) optimisant le contrôle post-prandial, des améliorations algorithmiques permettant une détection automatisée des repas, ou encore l’apport de l’intelligence artificielle pour intégrer à l’algorithme différents paramètres contextuels fournis par le smartphone et/ou la montre connectée (accéléromètre, fréquence cardiaque, agenda, géolocalisation…). Tous ces développements visent à rendre les systèmes de BF de plus en plus automatisés, afin de limiter les interventions « manuelles » du patient, pour aboutir in fine à un pancréas artificiel capable de gérer de façon autonome toutes les situations physiologiques ou extraphysiologiques (repas, collations, périodes de jeûne, activité physique plus ou moins intense, situation de maladie intercurrente…).17
L’intelligence artificielle en diabétologie
Dans toutes les activités humaines, l’arrivée de l’intelligence artificielle (IA) semble imminente, avec des champs d’application potentiels toujours plus nombreux. La santé est également concernée au premier plan et tout particulièrement la diabétologie, du fait de la grande connectivité des outils actuellement utilisés.
Pour rappel, l’IA se définit par l’ensemble des théories et des techniques développant des programmes informatiques complexes capables de simuler certains traits de l’intelligence humaine. L’IA a pour but le raisonnement, l’apprentissage, la production de contenus, la prise de décision de manière rationnelle, à partir de données nombreuses et/ou complexes, au-delà des capacités de l’intelligence humaine.18
L’IA est déjà largement utilisée en santé pour l’élaboration de nouveaux médicaments et notamment pour le repositionnement médicamenteux qui consiste à tester, sur de nouvelles cibles et dans de nouvelles indications, des molécules déjà utilisées par ailleurs. Ainsi, l’IA peut tester les capacités de liaison à une cible thérapeutique de centaines de milliers de ligands potentiels issus de catalogues de composés chimiques, grâce à des modélisations tridimensionnelles d’interaction ligand-récepteur. C’est cette application de l’IA qui a permis, lors de la pandémie Covid, d’identifier très rapidement, dès 2020, saquinavir, lithospermic acid et 11m_32045235 comme des inhibiteurs potentiels d’une protéase du SARS-CoV- 2.19
Le NLP (natural language processing) est une autre application de l’IA en plein essor dans le domaine de la santé, dont le but est la compréhension du langage écrit et/ou oral, afin d’en extraire des données structurées ensuite facilement exploitables. Par exemple, le NLP est utilisé par plusieurs logiciels qui extraient automatiquement, à partir d’une banque de courriers médicaux, de comptes-rendus de radiologie et de résultats biologiques, les critères d’inclusion et de non-inclusion d’une étude clinique afin d’identifier plus facilement les sujets potentiellement incluables dans cette étude.20
Des algorithmes d’IA de machine learning sont par ailleurs utilisés pour la prédiction du risque de développer un DT2 ou encore un diabète gestationnel, sur de multiples critères clinico-biologiques, ouvrant des perspectives de dépistage ciblé grâce à un tel pré-screening.21,22 Le machine learning est également utilisé pour l’analyse automatisée d’images de rétinophotographie, avec une sensibilité/spécificité > 90 % pour la plupart des solutions existantes.23 L’utilisation et la valorisation de ces systèmes de dépistage automatisée de la rétinopathie diabétique seront certainement précisées prochainement grâce à plusieurs études qui visent à évaluer les usages et les modèles médico-économiques qui pourraient être appliqués à de tels systèmes.
Des chatbots (ou fils de discussion automatisés) sont également développés, afin de proposer notamment aux patients DT2 du coaching motivationnel pour promouvoir l’activité physique et une alimentation adaptée. Les systèmes actuels de chatbots sont capables de tisser un vrai échange relationnel avec un patient, prenant en compte ses caractéristiques et les échanges antérieurs, et pouvant élaborer des stratégies de motivation et de persuasion pour favoriser des changements comportementaux.24
Pour le DT1, de nombreuses applications d’IA sont développées pour optimiser la gestion de la période prandiale qui reste difficile pour les patients, y compris avec les systèmes technologiques modernes comme les BF, du fait de la nécessité d’évaluer au plus juste la quantité de glucide qui sera ingérée au repas. Afin d’apporter une aide pratique au patient, des systèmes de quantification automatique ou semi-automatique des glucides sont déjà opérationnels, les plus performants faisant appel au deep learning pour permettre la reconnaissance automatique puis la quantification des glucides à partir d’une photo réalisée par le patient avec son smartphone.25 Des systèmes de détection automatisée de la prise alimentaire sont également en développement, dans le cadre des BF, afin de répondre aux oublis d’annonce des repas ou aux annonces retardées, qui impactent négativement l’équilibre métabolique des patients DT1. Le principe est d’utiliser l’IA ou des algorithmes de traitement du signal afin de détecter les montées brutales du taux de glucose interstitiel et de proposer en réponse un bolus d’insuline automatisé afin de limiter l’excursion hyperglycémique post-prandiale. Les premières études pilotes ont montré la faisabilité et l’efficacité d’une telle détection automatisée des repas, annonçant dans les années à venir des systèmes de BF « totalement fermées ».26,27
L’IA n’a pas fini de nous surprendre avec des approches tout à fait inattendues et novatrices, comme l’utilisation de données électrocardiographiques pour détecter des variations de taux de glucose. En effet, une étude a été réalisée chez des patients non diabétiques en réanimation, qui étaient équipés d’un capteur de glucose interstitiel et d’un électrocardiogramme (ECG) en continu. Les profils de glucose et les tracés ECG ont été soumis à un système d’IA (machine learning) qui a ainsi pu détecter de minimes variations des complexes QRS et de la repolarisation lorsque le glucose interstitiel était bas. Ce système d’IA a ensuite été testé sur des tracés ECG, sans avoir accès aux profils de glucose mais a cependant réussi à identifier les périodes de glucose bas, uniquement par l’analyse des variations ECG, avec une excellente sensibilité/spécificité.28 L’IA semble donc capable d’identifier des associations et d’extraire des informations pertinentes en croisant des bases de données complexes qui ne pourraient pas être analysées par le cerveau humain.
Au vu du développement rapide de l’IA, il paraît légitime de s’interroger sur l’avenir des professionnels de santé qui semblent même concurrencés sur le terrain de l’empathie, qualité pourtant réputée très « humaine ». Une récente étude s’est intéressée aux réponses apportées par des médecins aux questions de patients sur un forum de discussion. Ces mêmes questions ont été soumises ensuite à une IA générative (ChatGPT) et les réponses de l’IA ont été comparées aux réponses des médecin, en aveugle, par un comité d’experts indépendants. Pour près de 80 % des questions, les experts ont estimé que la meilleure réponse avait été proposée par l’IA, aussi bien sur le fond que sur la forme, avec notamment un meilleur niveau d’empathie.29
De nombreuses interrogations accompagnent l’arrivée de l’IA, en particulier concernant le contrôle, la validation, la valorisation, mais également la responsabilité, la propriété des données analysées et produites. L’élaboration d’un cadre réglementaire et légal est indispensable et prendra un peu de temps mais il semble évident que les professionnels de santé doivent dès maintenant réfléchir à la façon d’intégrer progressivement l’IA dans leurs pratiques.
« Mon espace santé »
Pour conclure cet article concernant les mutations numériques de la diabétologie, il semble indispensable de citer « Mon espace santé », un espace numérique personnel et sécurisé, proposé par l’Assurance Maladie et le ministère de la Santé, qui a vocation à devenir le carnet de santé numérique de tous les assurés. Grâce à ce service, chaque personne peut participer activement au suivi et à la préservation de sa santé, en stockant de manière sécurisée toutes ses données de santé et en les partageant avec les professionnels de santé de son choix. Au-delà du simple stockage des informations, cet espace permet d’accéder à une messagerie sécurisée pour les échanges de documents médicaux, permet de désigner une personne de confiance qui pourrait être consultée par les professionnels de santé en cas d’incapacité du patient à s’exprimer, et permettra demain de disposer d’un agenda sécuriser pour organiser les rendez-vous en lien avec la santé.
Dès maintenant, les personnes qui ont activé « Mon espace santé » voient s’implémenter automatiquement leur dossier numérique lorsqu’ils consultent un professionnel de santé, vont à la pharmacie avec une prescription ou bénéficient d’un examen d’imagerie médicale. Progressivement, la grande majorité des évènements, documents, comptes-rendus, imageries, enregistrements… concernant la santé d’une personne, convergeront vers son espace numérique, optimisant ainsi la traçabilité du parcours de santé d’un patient, accessible à tous les professionnels qu’il aura autorisés.
Les dispositifs médicaux ainsi que les plateformes numériques de santé projettent de pouvoir s’interfacer avec « Mon espace santé », outil numérique désormais incontournable de chaque patient. Le monde de la diabétologie n’échappe pas à cette règle et plusieurs industriels développant des capteurs de glucose ou des plateformes de suivi sont déjà très avancés dans la structuration technique et réglementaire d’une interopérabilité entre leur solution et « Mon espace santé ».
Il reste encore bien sûr du chemin avant que « Mon espace santé » soit utilisé en routine par tous les usagers, tous les professionnels de la santé et tous les industriels de la e-santé mais cet espace numérique représente l’infrastructure indispensable autour de laquelle pourra s’organiser la révolution digitale en marche.
2. Heinemann L, Schnell O, Gehr B et al. Digital Diabetes Management: A Literature Review of Smart Insulin Pens. J Diabetes Sci Technol 2022;16:587-595. doi: 10.1177/1932296820983863.
3. Joubert M, Benhamou PY, Schaepelynck P et al. Remote Monitoring of Diabetes: A Cloud-Connected Digital System for Individuals With Diabetes and Their Health Care Providers. J Diabetes Sci Technol 2019 ;13:1161-1168. doi: 10.1177/1932296819834054.
4. Arrêté du 22 juin 2023 portant inscription d’activités de télésurveillance médicale sur la liste prévue à l’article L. 162-52 du code de la sécurité sociale. JORF n°0145 du 24 juin 2023. NOR : SPRS2317273A.
5. Lee P, Greenfield G, Pappas Y. The impact of telehealth remote patient monitoring on glycemic control in type 2 diabetes: a systematic review and meta-analysis of systematic reviews of randomised controlled trials. BMC Health Serv Res 2018;18:495. doi: 10.1186/s12913-018-3274-8.
6. Bekiari E, Kitsios K, Thabit H, et al. Artificial pancreas treatment for outpatients with type 1 diabetes: systematic review and meta-analysis. BMJ. 2018;361:k1310.
7. Karageorgiou V, Papaioannou TG, Bellos I, et al. Effectiveness of artificial pancreas in the non-adult population: A systematic review and network meta-analysis. Metabolism. 2019;90:20-30.
8. Silva JD, Lepore G, Battelino T, et al. Real-World Performance of the MiniMed 780G System: First Report of Outcomes from 4120 Users. Diabetes Technol Ther. 2022;24(2):113-9.
9. Benhamou PY, Adenis A, Lebbad H, et al. One-year real-world performance of the DBLG1 closed-loop system: Data from 3706 adult users with type 1 diabetes in Germany. Diabetes Obes Metab. 2023;25(6):1607-13.
10. Kovatchev BP, Singh H, Mueller L, Gonder-Frederick LA. Biobehavioral Changes Following Transition to Automated Insulin Delivery: A Large Real-life Database Analysis. Diabetes Care. 2022;45(11):2636-43.
11. ElSayed NA, Aleppo G, Aroda VR, et al. 7. Diabetes Technology: Standards of Care in Diabetes-2023. Diabetes Care. 2023;46(Suppl 1):S111-S27.
12. Holt RIG, DeVries JH, Hess-Fischl A, et al. The Management of Type 1 Diabetes in Adults. A Consensus Report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2021;44(11):2589-625.
13. Phillip M, Nimri R, Bergenstal RM, et al. Consensus Recommendations for the Use of Automated Insulin Delivery (AID) Technologies in Clinical Practice. Endocr Rev 2023;44:254-280.
14. Tubiana-Rufi N, Schaepelynck P, Franc S, et al. Practical implementation of automated closed-loop insulin delivery: a French position statement. Diabetes Metab 2021;47:101206.
15. Bally L, Thabit H, Hartnell S, et al. Closed-Loop Insulin Delivery for Glycemic Control in Noncritical Care. N Engl J Med. 2018;379(6):547-56.
16. Daly AB, Boughton CK, Nwokolo M, et al. Fully automated closed-loop insulin delivery in adults with type 2 diabetes: an open-label, single-center, randomized crossover trial. Nat Med. 2023;29(1):203-8.
17. Templer S. Closed-Loop Insulin Delivery Systems: Past, Present, and Future Directions. Front Endocrinol (Lausanne). 2022;13:919942.
18. Boden M. Artificial Intelligence and Natural Man. New York, NY: Basic Books; 1977.
19. Gupta R, Srivastava D, Sahu M et al. Artificial intelligence to deep learning: machine intelligence approach for drug discovery. Mol Divers 2021;25:1315-1360.
20. Joseph N,Lindblad I, Zaker S et al. Automated data extraction of electronic medical records: Validity of data mining to construct research databases for eligibility in gastroenterological clinical trials. Ups J Med Sci 2022 Jan 27;127. doi: 10.48101/ujms.v127.8260
21. Deberneh H, Kim I. Prediction of Type 2 Diabetes Based on Machine Learning Algorithm. Int J Environ Res Public Health 2021 Mar 23;18(6):3317.
22. Gallardo-Rincon H, Rios-Blancas M, Ortega-Montiel J et al. MIDO GDM: an innovative artificial intelligence-based prediction model for the development of gestational diabetes in Mexican women. Sci Rep 2023;13(1):6992. doi: 10.1038/s41598-023-34126-7.
23. Gargeya R, Leng T. Automated Identification of Diabetic Retinopathy Using Deep Learning. Ophthalmology 2017;124(7):962-969. doi: 10.1016/j.ophtha.2017.02.008.
24. Abhari S, Niakan Kalhori S, Ebrahimi M et al. Artificial Intelligence Applications in Type 2 Diabetes Mellitus Care: Focus on Machine Learning Methods. Healthc Inform Res 2019;25(4):248-261. doi: 10.4258/hir.2019.25.4.248.
25. Joubert M, Meyer L, Doriot A, et al. Prospective Independent Evaluation of the Carbohydrate Counting Accuracy of Two Smartphone Applications. Diabetes Ther 2021;12(7):1809-1820. doi: 10.1007/s13300-021-01082-2.
26. Daniels J, Herrero P, Georgiou P. A Deep Learning Framework for Automatic Meal Detection and Estimation in Artificial Pancreas Systems. Sensors (Basel) 2022 Jan 8;22(2):466.
27. Palisaitis E, El Fathi A, von Oettingen J et al. A Meal Detection Algorithm for the Artificial Pancreas: A Randomized Controlled Clinical Trial in Adolescents With Type 1 Diabetes. Diabetes Care 2021 Feb;44(2):604-606. doi: 10.2337/dc20-1232
28. Porumb M, Stranges S, Pescape A et al. Precision Medicine and Artificial Intelligence: A Pilot Study on Deep Learning for Hypoglycemic Events Detection based on ECG. Sci Rep 2020 Jan 13;10(1):170. doi: 10.1038/s41598-019-56927-5.
29. Ayers J, Poliak A, Dredze M, et al. Comparing Physician and Artificial Intelligence Chatbot Responses to Patient Questions Posted to a Public Social Media Forum. JAMA Intern Med. 2023;183(6):589-596. doi: 10.1001/jamainternmed.2023.1838.