Le prix Nobel 2021 de médecine et physiologie a été attribué à David Julius, actuellement professeur à l’université de Californie à San Francisco, et à Ardem Patapoutian, professeur au Scripps Research Institute à La Jolla puis au Howard Hugues Medical Institute à Chevy Chase. À Stockholm, le jury Nobel a déclaré que « leurs découvertes révolutionnaires ont permis de comprendre comment la chaleur, le froid et la force mécanique peuvent être à l’origine des impulsions nerveuses qui nous permettent de percevoir et de nous adapter au monde ».
La perception des températures ou des multiples sensations mécaniques, ainsi que celles de la douleur ou du prurit sont connues depuis toujours et la mise en évidence de terminaisons nerveuses spécifiques est une donnée classique. Mais les mécanismes moléculaires permettant de transformer des signaux physiques en influx nerveux restaient bien mystérieux. De plus, que le contact avec des substances chimiques issues d’aliments (piment, wasabi, menthe) puisse induire de telles sensations restait très surprenant, tout en ouvrant une voie à la compréhension de ces mécanismes moléculaires.
La perception des températures ou des multiples sensations mécaniques, ainsi que celles de la douleur ou du prurit sont connues depuis toujours et la mise en évidence de terminaisons nerveuses spécifiques est une donnée classique. Mais les mécanismes moléculaires permettant de transformer des signaux physiques en influx nerveux restaient bien mystérieux. De plus, que le contact avec des substances chimiques issues d’aliments (piment, wasabi, menthe) puisse induire de telles sensations restait très surprenant, tout en ouvrant une voie à la compréhension de ces mécanismes moléculaires.
David Julius : TRPV1, TRPM8 et TRPA1
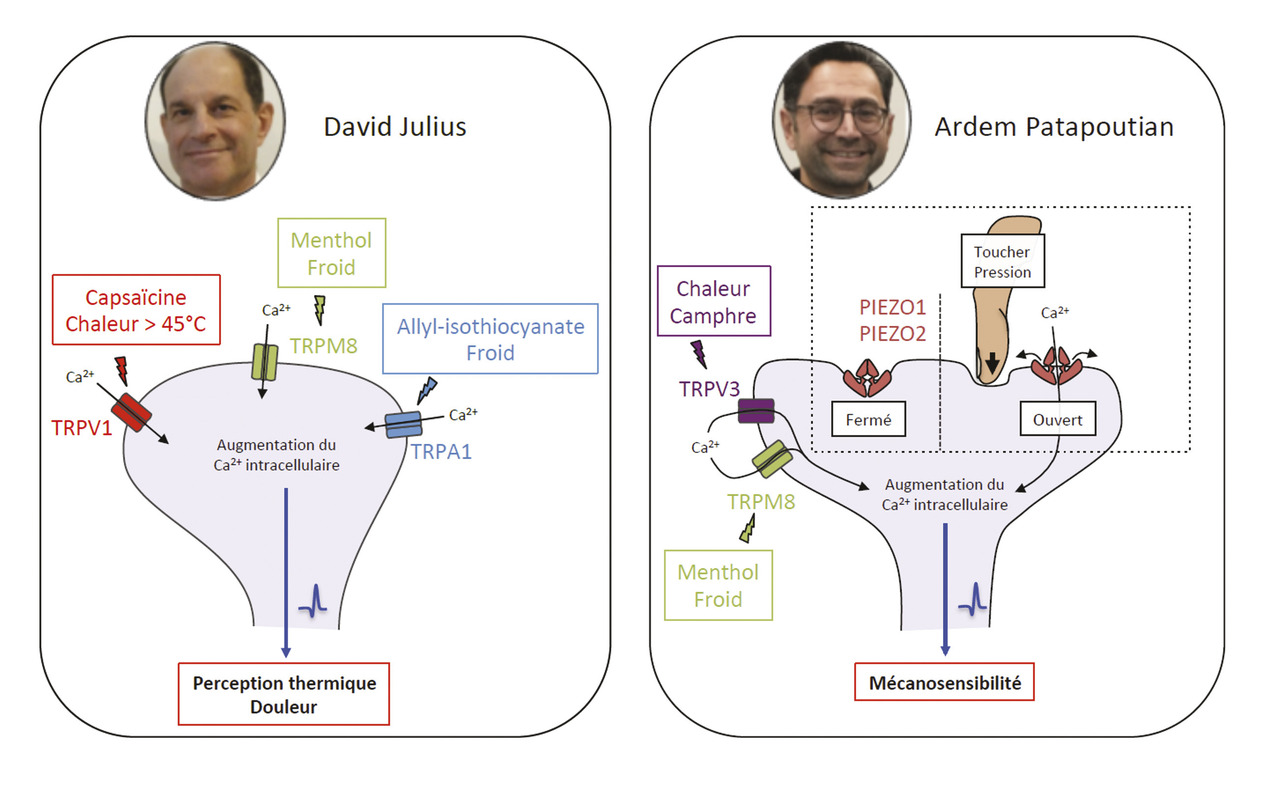
En 1997, David Julius (fig. 1 ) et son équipe ont cloné et caractérisé le récepteur TRPV1 (pour transient receptor potential vanilloid 1), qui est activé par la capsaïcine, la substance contenue dans les piments, de la famille des vanilloïdes, responsable de cette sensation bien connue de picotement, voire de brûlure ou de douleur.1 Ils ont ensuite découvert que ce récepteur est aussi sensible à la chaleur perçue comme douloureuse (supérieure à 44 °C).2 Les souris knock-out dépourvues de TRPV1 perdent d’ailleurs à la fois leur sensibilité à la capsaïcine et à la chaleur douloureuse.3 En réponse à un de ces stimuli, TRPV1, situé à l’extrémité des neurones sensitifs, change de conformation, ce qui entraîne son ouverture : des ions calcium et sodium entrent alors dans la cellule et déclenchent le signal neuronal.
L’équipe de David Julius a ensuite poursuivi ses travaux sur la famille des TRP, ces canaux cationiques fonctionnant selon le même principe. Elle a cloné et caractérisé le récepteur TRPM8 (transient receptor potential melastatin 8), activé par le menthol ou le froid.4,5 Puis elle a réalisé le même travail pour TRPA1 (transient receptor potential ankyrin 1), qui détecte aussi bien l’allyl-isothiocyanate, à l’origine du goût de la moutarde et du wasabi, que le froid douloureux.6 Comme TRPV1, il déclenche des larmes et une toux lors de l’ingestion d’un aliment qualifié de « fort ».
Plus récemment, David Julius a décrit la structure de ces différents récepteurs, étape indispensable pour comprendre leur fonction, en utilisant la cryomicroscopie électronique (un échantillon est congelé avant d’être observé au microscope électronique).7, 8
L’équipe de David Julius a ensuite poursuivi ses travaux sur la famille des TRP, ces canaux cationiques fonctionnant selon le même principe. Elle a cloné et caractérisé le récepteur TRPM8 (transient receptor potential melastatin 8), activé par le menthol ou le froid.4,5 Puis elle a réalisé le même travail pour TRPA1 (transient receptor potential ankyrin 1), qui détecte aussi bien l’allyl-isothiocyanate, à l’origine du goût de la moutarde et du wasabi, que le froid douloureux.6 Comme TRPV1, il déclenche des larmes et une toux lors de l’ingestion d’un aliment qualifié de « fort ».
Plus récemment, David Julius a décrit la structure de ces différents récepteurs, étape indispensable pour comprendre leur fonction, en utilisant la cryomicroscopie électronique (un échantillon est congelé avant d’être observé au microscope électronique).7, 8
Ardem Patapoutian ou : TRPM8, PIEZO1, PIEZO2 ET TRPV3
Ardem Patapoutian (fig. 2 ) et son équipe ont aussi travaillé sur TRPM8 et montré simultanément qu’il percevait aussi bien le froid que le menthol.9
Ils ont aussi cloné et caractérisé le récepteur TRPV3, sensible à la chaleur, à partir de kératinocytes (prouvant ainsi que les kératinocytes avaient une fonction sensorielle)10 puis montré que les souris knock-out dépourvues de TRPV3 perdent d’ailleurs leur sensibilité au camphre et à la chaleur.11
Parallèlement, ce groupe s’est intéressé aux mécanismes sur lesquels repose la perception des stimuli mécaniques. Celle-ci est une composante importante du toucher, un sens dont on oublie qu’il est aussi fin que la vision, mais elle est aussi utile pour percevoir le sang qui circule, l’air qui gonfle les poumons, l’estomac ou la vessie qui se remplissent, détecter les ondes sonores dans l’oreille, la proprioception musculo-tendineuse, etc. Patapoutian et ses collaborateurs ont tout d’abord identifié une lignée cellulaire qui émettait un signal électrique mesurable lorsque des cellules étaient individuellement piquées avec une micropipette (patch clamp). Ils ont supposé que le récepteur activé par la force mécanique était un canal ionique et ont identifié 72 gènes candidats. Ces derniers ont été inactivés un par un afin de découvrir le gène responsable de la mécano-sensibilité des cellules étudiées, pour finalement identifier un nouveau canal ionique mécanosensible entièrement inconnu : Piezo1, dérivé du mot grec signifiant « pression ». Un deuxième gène a ensuite été découvert et nommé Piezo2. Piezo1 et Piezo2 sont des canaux ioniques directement activés par l’application d’une pression sur les membranes cellulaires.12, 13, 14
Parmi les collaborateurs d’Ardem Patapoutian, il faut remarquer deux brillants chercheurs actuellement à Marseille et qui ont fait un post-doctorat avec lui : Aziz Moqrich11 et Bertand Coste.12
Ils ont aussi cloné et caractérisé le récepteur TRPV3, sensible à la chaleur, à partir de kératinocytes (prouvant ainsi que les kératinocytes avaient une fonction sensorielle)10 puis montré que les souris knock-out dépourvues de TRPV3 perdent d’ailleurs leur sensibilité au camphre et à la chaleur.11
Parallèlement, ce groupe s’est intéressé aux mécanismes sur lesquels repose la perception des stimuli mécaniques. Celle-ci est une composante importante du toucher, un sens dont on oublie qu’il est aussi fin que la vision, mais elle est aussi utile pour percevoir le sang qui circule, l’air qui gonfle les poumons, l’estomac ou la vessie qui se remplissent, détecter les ondes sonores dans l’oreille, la proprioception musculo-tendineuse, etc. Patapoutian et ses collaborateurs ont tout d’abord identifié une lignée cellulaire qui émettait un signal électrique mesurable lorsque des cellules étaient individuellement piquées avec une micropipette (patch clamp). Ils ont supposé que le récepteur activé par la force mécanique était un canal ionique et ont identifié 72 gènes candidats. Ces derniers ont été inactivés un par un afin de découvrir le gène responsable de la mécano-sensibilité des cellules étudiées, pour finalement identifier un nouveau canal ionique mécanosensible entièrement inconnu : Piezo1, dérivé du mot grec signifiant « pression ». Un deuxième gène a ensuite été découvert et nommé Piezo2. Piezo1 et Piezo2 sont des canaux ioniques directement activés par l’application d’une pression sur les membranes cellulaires.12, 13, 14
Parmi les collaborateurs d’Ardem Patapoutian, il faut remarquer deux brillants chercheurs actuellement à Marseille et qui ont fait un post-doctorat avec lui : Aziz Moqrich11 et Bertand Coste.12
Tout cela a du sens !
Les découvertes révolutionnaires des canaux TRPV1, TRPV3, TRPM8, TRPA1 et Piezo par les lauréats du prix Nobel 2021 (fig. 3 ) nous ont permis de comprendre comment la chaleur, le froid et les forces mécaniques peuvent déclencher les impulsions nerveuses qui nous permettent de percevoir le monde qui nous entoure et de nous y adapter. Elles expliquent aussi pourquoi nous percevons une sensation de froid au contact du menthol ou de ses dérivés, ou de chaud (voire de brûlure) au contact du piment, de la moutarde, du wasabi ou du camphre, alors que notre température cutanée reste la même.
Les canaux TRP jouent un rôle central dans notre capacité à percevoir la température. Le canal Piezo2 nous confère le sens du toucher et la faculté de sentir la position et le mouvement des parties de notre corps. Les canaux TRP et Piezo contribuent également à de nombreuses autres fonctions physiologiques qui dépendent de la perception de la température ou de stimuli mécaniques. Des recherches intensives sont en cours pour élucider les fonctions des canaux TRP et piézoélectriques dans divers processus physiologiques, grâce aux découvertes de David Julius et Ardem Patapoutian.
Selon le comité Nobel, ces découvertes aideront à lutter contre diverses pathologies, en particulier celles qui se traduisent par des douleurs chroniques. En effet, le récepteur TRPV1 participe à l’hypersensibilité à la chaleur (une température modérée semble plus élevée qu’elle ne l’est réellement), par exemple après un coup de soleil. De même, le récepteur TRPA1 est sollicité lors d’une douleur liée à une inflammation. Enfin, les récepteurs Piezo2 sont notamment impliqués dans le phénomène d’allodynie, quand même le contact d’un vêtement devient insupportable. Ces connaissances sont utilisées pour mettre au point des traitements contre un large éventail de maladies, dont la douleur et le prurit chroniques, très liés aux phénomènes de sensibilisation périphérique, eux-mêmes conséquence de la sensibilisation, c’est-à-dire de l’hyperexcitabilité, de ces récepteurs.
Les canaux TRP jouent un rôle central dans notre capacité à percevoir la température. Le canal Piezo2 nous confère le sens du toucher et la faculté de sentir la position et le mouvement des parties de notre corps. Les canaux TRP et Piezo contribuent également à de nombreuses autres fonctions physiologiques qui dépendent de la perception de la température ou de stimuli mécaniques. Des recherches intensives sont en cours pour élucider les fonctions des canaux TRP et piézoélectriques dans divers processus physiologiques, grâce aux découvertes de David Julius et Ardem Patapoutian.
Selon le comité Nobel, ces découvertes aideront à lutter contre diverses pathologies, en particulier celles qui se traduisent par des douleurs chroniques. En effet, le récepteur TRPV1 participe à l’hypersensibilité à la chaleur (une température modérée semble plus élevée qu’elle ne l’est réellement), par exemple après un coup de soleil. De même, le récepteur TRPA1 est sollicité lors d’une douleur liée à une inflammation. Enfin, les récepteurs Piezo2 sont notamment impliqués dans le phénomène d’allodynie, quand même le contact d’un vêtement devient insupportable. Ces connaissances sont utilisées pour mettre au point des traitements contre un large éventail de maladies, dont la douleur et le prurit chroniques, très liés aux phénomènes de sensibilisation périphérique, eux-mêmes conséquence de la sensibilisation, c’est-à-dire de l’hyperexcitabilité, de ces récepteurs.
Références
1. Caterina MJ, Schumacher MA, Tominaga M, Rosen TA, Levine JD, Julius D. The capsaicin receptor : a heat-activated ion channel in the pain pathway. Nature1997;389:816-24.
2. Tominaga M, Caterina MJ, Malmberg AB, Rosen TA, Gilbert H, Skinner K, et al. The cloned capsaicin receptor integrates multiple pain-producing stimuli. Neuron 1998;21:531-43.
3. Caterina MJ, Leffler A, Malmberg AB, Martin WJ, Trafton J, Petersen-Zeitz KR, et al. Impaited nociception and pain sensation in mice lacking the capsaicin recptor. Science 2000;288:306-13.
4. Mac Kemy DD, Neuhausser WM, Julius D. Identification of a cold receptor reveals a general role for TRP channels in thermosensation. Nature 2002;416:52-8.
5. Bautista DM, Siemens J, Glazer JM, Tsuruda PR, Basbaum AI, Stucky CL, et al. The menthol receptor TRPM8 is the principal detector of environmental cold. Nature 2007;448:204-8.
6. Jordt SE, Bautista DM, Chuang HH, McKemy DD, Zygmunt PM, Högestätt ED, et al. Mustard oils and cannabinoids excite nerve fibers through the TRP channel ANKTM1. Nature 2004;427:260-5.
7. Liao M, Cao E, Julius D, Cheng Y. Structure of the TRPV1 ion channel determined by electron cryomicroscopy. Nature 2013;504:107-12.
8. Cao E, Liao M, Cheng Y, Julius D. TRPV1 structures in distinct conformations reveal activation mechanisms. Nature 2013;504:113-8.
9. Peier AM, Moqrich A, Hergarden AC, Reeve AJ, Andersson DA, Story GM, et al. A TRP channel that senses cold stimuli and menthol. Cell 2002:108:705-715.
10. Peier AM, Reeve AJ, Andersson DA, Moqrich A, Earley TJ, Hergarden AC, et al. A heat-sensitive TRP channel expressed in keratinocytes. Science 2002;296:2046-9.
11. Moqrich A, Hwang SW, Earley TJ, Petrus MJ, Murray AN, Spencer KSR, et al. Impaired thermosensation in mice lacking TRPV3, a heat and camphor sensor in the skin. Science 2005;307:1468-72.
12. Coste B, Mathur J, Schmidt M, Earley TJ, Ranade S, Petrus MJ, et al. Piezo1 and Piezo2 are essential components of distinct mechanically activated cation channels. Science 2010:330:55-60.
13. Ranade SS, Woo SH, Dubin AE, Moshourab RA, Wetzel C, Petrus M, et al. Piezo2 is the major transducer of mechanical forces for touch sensation in mice. Nature 2014:516:121-5.
14. Woo SH, Lukacs V, de Nooij JC, Zaytseva D, Criddle CR, Francisco A, et al. Piezo2 is the principal mechanotransduction channel for proprioception. Nat Neurosci 2015;18:1756-62.
2. Tominaga M, Caterina MJ, Malmberg AB, Rosen TA, Gilbert H, Skinner K, et al. The cloned capsaicin receptor integrates multiple pain-producing stimuli. Neuron 1998;21:531-43.
3. Caterina MJ, Leffler A, Malmberg AB, Martin WJ, Trafton J, Petersen-Zeitz KR, et al. Impaited nociception and pain sensation in mice lacking the capsaicin recptor. Science 2000;288:306-13.
4. Mac Kemy DD, Neuhausser WM, Julius D. Identification of a cold receptor reveals a general role for TRP channels in thermosensation. Nature 2002;416:52-8.
5. Bautista DM, Siemens J, Glazer JM, Tsuruda PR, Basbaum AI, Stucky CL, et al. The menthol receptor TRPM8 is the principal detector of environmental cold. Nature 2007;448:204-8.
6. Jordt SE, Bautista DM, Chuang HH, McKemy DD, Zygmunt PM, Högestätt ED, et al. Mustard oils and cannabinoids excite nerve fibers through the TRP channel ANKTM1. Nature 2004;427:260-5.
7. Liao M, Cao E, Julius D, Cheng Y. Structure of the TRPV1 ion channel determined by electron cryomicroscopy. Nature 2013;504:107-12.
8. Cao E, Liao M, Cheng Y, Julius D. TRPV1 structures in distinct conformations reveal activation mechanisms. Nature 2013;504:113-8.
9. Peier AM, Moqrich A, Hergarden AC, Reeve AJ, Andersson DA, Story GM, et al. A TRP channel that senses cold stimuli and menthol. Cell 2002:108:705-715.
10. Peier AM, Reeve AJ, Andersson DA, Moqrich A, Earley TJ, Hergarden AC, et al. A heat-sensitive TRP channel expressed in keratinocytes. Science 2002;296:2046-9.
11. Moqrich A, Hwang SW, Earley TJ, Petrus MJ, Murray AN, Spencer KSR, et al. Impaired thermosensation in mice lacking TRPV3, a heat and camphor sensor in the skin. Science 2005;307:1468-72.
12. Coste B, Mathur J, Schmidt M, Earley TJ, Ranade S, Petrus MJ, et al. Piezo1 and Piezo2 are essential components of distinct mechanically activated cation channels. Science 2010:330:55-60.
13. Ranade SS, Woo SH, Dubin AE, Moshourab RA, Wetzel C, Petrus M, et al. Piezo2 is the major transducer of mechanical forces for touch sensation in mice. Nature 2014:516:121-5.
14. Woo SH, Lukacs V, de Nooij JC, Zaytseva D, Criddle CR, Francisco A, et al. Piezo2 is the principal mechanotransduction channel for proprioception. Nat Neurosci 2015;18:1756-62.
Une question, un commentaire ?