Historique de la mesure du glucose au cours du diabète : place de l’auto-surveillance glycémique conventionnelle par glycémie capillaire
Développée depuis les années 1980, l'autosurveillance de la glycémie (ASG) est considérée comme faisant partie intégrante de la gestion du diabète, en particulier pour les personnes nécessitant un traitement par insuline [1]. Les lecteurs de glycémie mesurent la glycémie grâce à un échantillon de sang capillaire prélevé au bout du doigt, et les données sont utilisées par les patients et les cliniciens pour éclairer les décisions concernant l'ajustement de la dose d'insuline, l'utilisation d'autres médicaments à risque hypoglycémique ou les conditions d’hygiène de vie de vie, nutritionnelles ou d’activité physique en particulier.
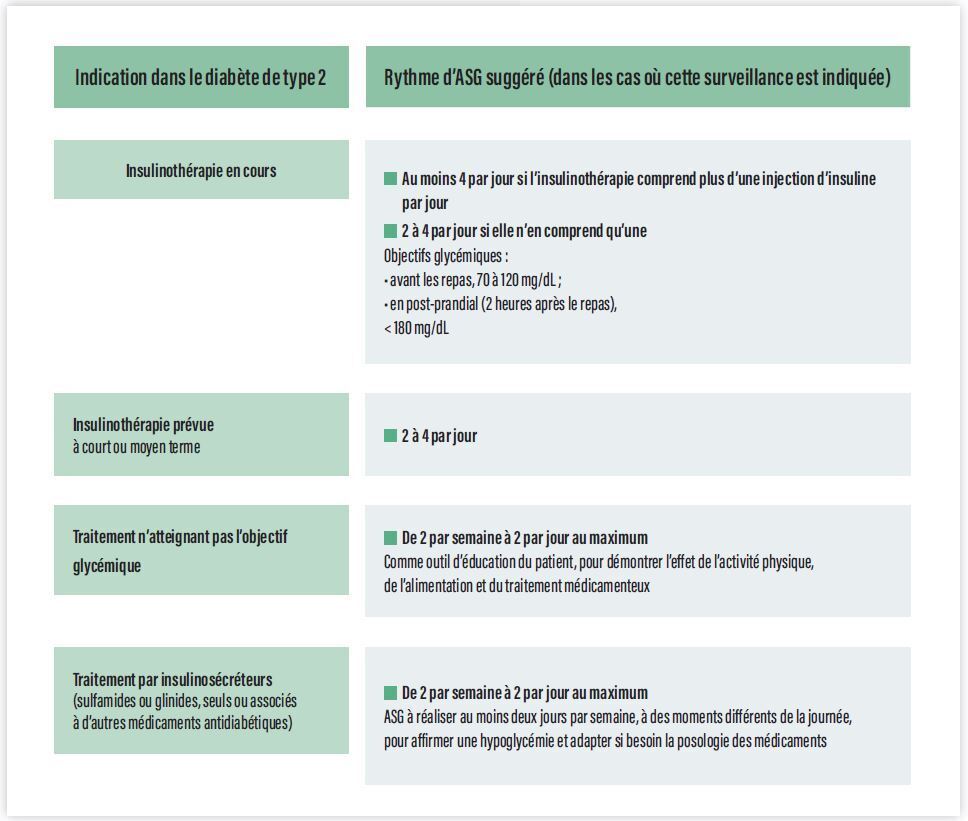
Des recommandations proposant des algorithmes de traitement pour optimiser le contrôle glycémique ont été régulièrement publiées [2 - 4]. L’autosurveillance glycémique (ASG) est ainsi évoquée comme une pratique indispensable en cas d’insulinothérapie dans le diabète de type 1 (DT1) comme dans le diabète de type 2 (DT2). Depuis 2011, la Haute Autorité de santé (HAS) recommande aussi l’usage de l’ASG chez les patients pour lesquels une insulinothérapie est envisagée à court ou moyen terme, ceux traités par insulino-sécréteurs (sulfamides ou glinides, seuls ou associés à d’autres médicaments antidiabétiques), lorsque des hypoglycémies sont soupçonnées et chez les patients pour lesquels l’objectif thérapeutique n’est pas atteint, notamment en raison d’une maladie ou d’un traitement intercurrent (Figure 1) [5]. Les recommandations de la HAS de 2013 sur la prise en charge du patient atteint de diabète de type 2 (recommandations 39 à 45 ; (Figure 2) précisent également les contours de cette utilisation [2].
Les preuves de l'efficacité de l’ASG chez les personnes atteintes de diabète de type 2 non insulino-traité restent néanmoins débattues [6]. Dans une série de revues systématiques et de méta-analyses, les estimations de l'effet de cette ASG varient considérablement selon la méthodologie des essais [7 - 11].
Ainsi, l’ASG ne doit être ni systématique ni passive, et s’inscrire dans une démarche d’éducation du patient, et de son entourage le cas échéant. Les mesures doivent être susceptibles d’entraîner des conséquences thérapeutiques. Pour exemple, l'étude STeP (Structured Testing Program) menée auprès de personnes atteintes de diabète de type 2 a démontré que l’ASG structurée contribuait de manière significative à l'amélioration du contrôle glycémique et des attitudes psychosociales des patients par rapport aux soins habituellement appliqués [12]. De même, dans l'essai PRISMA, la réalisation d'une autosurveillance glycémique structurée a été associée à de meilleurs résultats cliniques [13]. Dans ce contexte, l’ASG est reconnue comme d’intérêt pratique dans des études de recherche clinique [14], où elle est développée pour améliorer la prise de conscience des effets de la modification du mode de vie et l'adaptation du traitement, y compris dans des études portant sur les insulines de deuxième génération, les agonistes du récepteur du GLP- 1 et les inhibiteurs du cotransporteur sodium-glucose 2 (iSGLT2).
Malgré tout, même mené intensivement avec plusieurs contrôles glycémiques capillaires journaliers, l’ASG ne donne que des informations ponctuelles et transversales correspondant au moment de sa réalisation, et ne reflète que partiellement l’ampleur du phénomène de variabilité glycémique, ses caractéristiques de survenue et/ou son évolution dans le temps. Ceci est particulièrement vrai pour la détection et la prévention des épisodes hypoglycémiques, des excursions glycémiques post-prandiales liées aux repas, ou encore au cours de l’activité physique. Ces limites de l’ASG expliquent par conséquent l’intérêt du développement de capteurs de glucose dont la fonction est de mesurer en continu la concentration de glucose en sous-cutané dans le tissu interstitiel. Ces systèmes de mesure en continu du glucose sont à l’origine d’un engouement sans précédent pour trois raisons essentielles :
- Tout d’abord, le fait que les patients diabétiques traités par insuline ou insulino-sécrétagogues, présentent une fréquence potentiellement élevée d’épisodes hypoglycémiques modérés à sévères [15]. L’association de troubles du rythme cardiaque identifiés par un holter ECG à l’occasion d’épisodes hypoglycémiques nocturnes enregistrés par capteur de glucose chez des patients DT1 comme DT2 illustre bien l’ampleur et la gravité du problème posé au clinicien [16,17].
- En second, l’exigence qui est faite au patient de mesurer fréquemment sa glycémie capillaire au cours de la journée et de la nuit afin de tirer un bénéfice maximum d’une insulinothérapie intensifiée pour le patient DT1 ou d’un choix stratégique d’antidiabétiques oraux ou injectables chez le patient DT2.
- Enfin et surtout, une mesure fiable et continue des concentrations de glucose trouve toute sa justification lorsqu’elle est associée à un système de délivrance en continu de l’insuline à partir d’une pompe portable ou implantable, avec le développement récent de systèmes experts de « boucle fermée hybride ».
Changement de paradigme pour la surveillance du glucose : l’usage privilégié de la mesure continue du glucose par capteur sous-cutané
La technologie des capteurs de glucose pour une mesure en continue du glucose
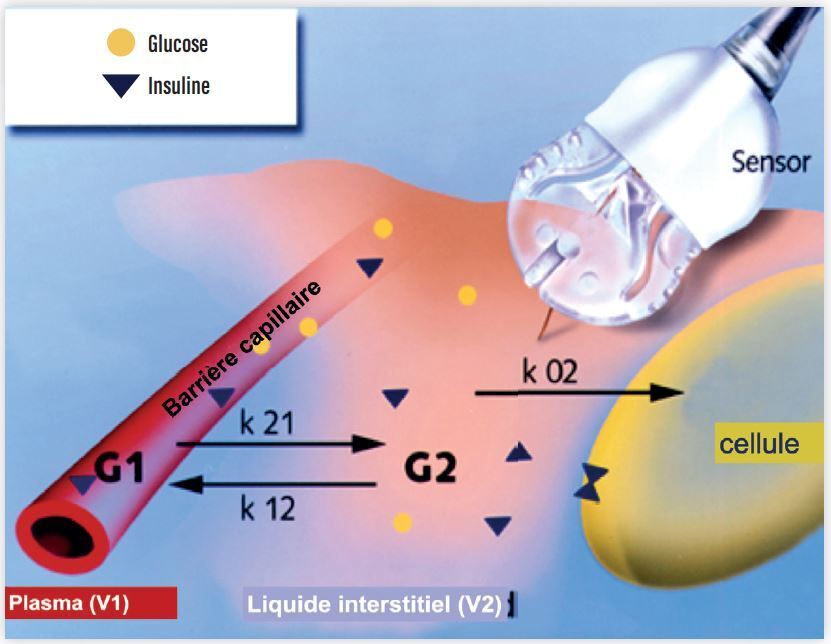
La mesure continue du glucose (MCG) à l’aide de capteurs positionnés en permanence dans le tissu sous-cutané, permet de mesurer la concentration du glucose dans le milieu extra-vasculaire, et plus précisément dans le milieu interstitiel. Ce choix technologique repose sur la démonstration de corrélations fortes entre les concentrations de glucose dans le milieu interstitiel et vasculaire, même s’il n’existe pas de concordance parfaite. Ces différences tiennent en partie à des raisons physiologiques d’action de masse et de captation cellulaire du glucose sous l’action de l’insuline, tant en phase statique que dynamique [18] (Figure 3).
Les premiers modèles de capteurs de glucose de type « holter » ont été développés au début des années 2000 et proposés en utilisation clinique hospitalière tout d’abord, puis en ambulatoire. Ces capteurs de glucose peuvent être utilisés de deux manières : sur une courte période de temps à des fins diagnostiques ou éducatives (encore appelé MCG professionnelle ou "Holter glycémique"), ou à long terme avec des lectures en temps réel (appelé MCG personnelle). La MCG professionnelle permet d'explorer le profil glycémique ambulatoire d'un patient dans des conditions de vie ordinaire, en analysant rétrospectivement après téléchargement l’ensemble des données enregistrées.
Aujourd’hui, la mesure en continu du glucose (MCG) est largement prescrite par les médecins et adoptée par les patients. Il existe également des consensus (inter)nationaux sur les modalités d’utilisation, les indications médicales [19], et la manière d’interpréter les résultats [20]. De nombreux dispositifs médicaux sont disponibles et permettent d’obtenir une MCG en temps réel. Cette révolution dans la surveillance du diabète permet ainsi à des milliers de patients d’abandonner la conventionnelle autosurveillance glycémique par mesure capillaire du glucose.
Les indications d’utilisation et remboursement des capteurs de glucose
Les indications d’utilisation, comme le champ de remboursement de ces capteurs de glucose, sont variables d’un pays à un autre, et évoluent au fil des nouvelles données mises à disposition.
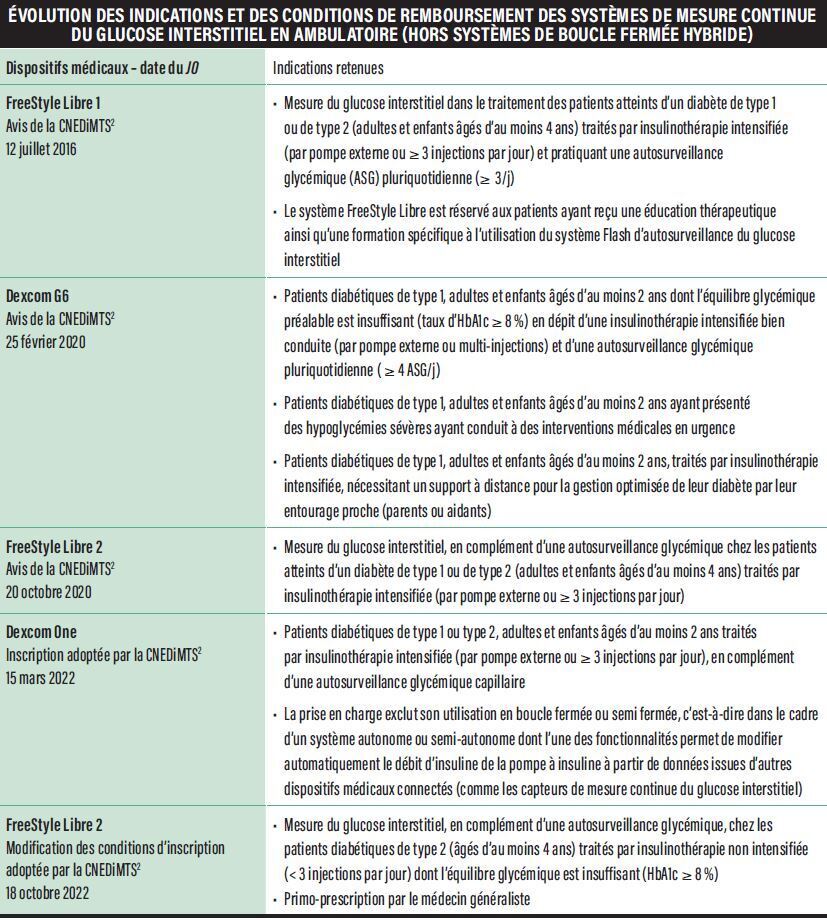
Depuis le 1er juin 2017, en France, c’est le FreeStyle Libre 1 (FSL1) qui a fait son apparition sur le marché en qualité de premier capteur de glucose remboursé pour tous les patients DT1 et DT2 traités par au moins 3 injections d’insuline ou une pompe à insuline, et effectuant préalablement au moins 3 autocontrôles glycémiques au bout du doigt. Appareil de surveillance du glucose mini-invasif posé pour 14 jours, il facilite l'évaluation des concentrations de glucose sans avoir besoin de mesures capillaires de contrôle (calibration en usine), par réalisation des scans intermittents (système Flash d’autosurveillance du glucose). Depuis 2021, un modèle freestyle libre 2 (FSL2) est disponible, dont l’évolution technique est marquée par la possibilité de programmer des alarmes optionnelles et réglables d’hypo- ou d’hyperglycémie, fonctionnant sous forme de notification et avertissant le patient même en l’absence de pratique de scan du capteur de glucose. C’est une avancée majeure dans la gestion de l’équilibre glycémique des patients. Ce modèle FSL2 bénéficie désormais d’un large remboursement auprès des patients DT1 et DT2 et sans condition de réalisation préalable d’une ASG conventionnelle renforcée (à la différence des conditions de remboursement du FSL1)[21]. Une version améliorée (notamment en réduction de taille du capteur) de mesure en temps réel (FreeStyle libre 3) est soumise pour accord aux autorités de santé en vue de son remboursement. En attendant, des avancées techniques sur les applications iphone ou androïde permettent d’ores et déjà de suivre en visuel direct les valeurs de glucose mesurées par le capteur sous-cutané. D’autres capteurs de glucose ont également obtenu un remboursement pour les patients DT1, adultes et enfants âgés d’au moins 2 ans, mais sous conditions métaboliques dégradées, à savoir une HbA1c ≥à 8,0 % ou la survenue d’une hypoglycémie sévère auto-déclarée par le patient dans les 12 mois précédents. C’est le cas depuis 2020 du capteur de glucose Dexcom G6 (calibré en usine donc sans nécessité d’ASG complémentaire), dont la durée d’utilisation est de 10 jours [22]. Les patients DT1, adultes et enfants âgés d’au moins 2 ans, nécessitant un support à distance pour la gestion optimisée de leur diabète par leur entourage proche (parents ou aidants) entrent également dans le champ du remboursement. D’autres capteurs de glucose sont également disponibles mais destinés à être couplés à une insulinothérapie intensifiée sous-cutanée par pompe à insuline, dans le cadre des « boucles fermées hybrides ».
Nouvelles indications, nouveaux capteurs et remboursements dans l’utilisation de la MCG chez le patient atteint de diabète de type 2
Récemment, des études de cohortes provenant de la base du SNDS (Système national des données de santé) ont permis de démontrer que l’utilisation de la mesure continue du glucose par scans intermittents (FGM [Flash Glucose Monitoring]) s’accompagnait d’une réduction majeure des événements cliniques d’importance permettant d’élargir les indications d’utilisation et de remboursement de ce capteur de glucose applicable désormais à la population de patients DT2 sous insuline basale seule et dont l’HbA1c est ≥ à 8,0 % avec une primo-prescription par le médecin généraliste [23]. Depuis le mois d’Août 2023, un nouvel outil est également disponible [24] : il s’agit de capteur de glucose Dexcom One dont le remboursement s’applique aux patients DT1 ou DT2, adultes et enfants âgés d’au moins 2 ans traités par insulinothérapie intensifiée (par pompe externe ou ≥ 3 injections par jour), en complément d’une autosurveillance glycémique capillaire. En revanche sa prise en charge exclut son utilisation en boucle fermée ou semi fermée. Dans l’indication de boucle fermée (système Control-IQ), c’est le capteur de glucose Dexcom G6 dont le remboursement vient d’être annoncé et publié au Journal officiel le 1er Août 2023, pour les patients DT1, adultes et enfants âgés d’au moins 6 ans et dont l’équilibre glycémique préalable est insuffisant (taux d’HbA1c ≥ à 8 %) en dépit d’une insulinothérapie intensifiée bien conduite par pompe externe depuis plus de six mois et d’une autosurveillance glycémique pluriquotidienne (≥ 4/j) [25]. L’évolution des indications et remboursements des capteurs de glucose utilisés en ambulatoire est résumé sur le tableau.
Effets thérapeutiques en temps réel : amélioration de l’équilibre glycémique et du confort du patient
La question posée est celle de l’utilité des systèmes de mesure en continue du glucose, au-delà du confort que cela apporte au patient, en termes d’amélioration du contrôle glycémique, ainsi que sur la prévention des complications micro- ou macro-angiopathiques et des complications métaboliques.
Les données des études IMPACT chez le patient DT1 [26], et REPLACE chez le patient DT2 [27, 28], ont apporté la preuve que les outils de MCG (en particulier le FGM avec le FSL) réduisaient significativement le temps passé en hypoglycémie (temps passé sous la cible ou Time Below Range / TBR, dont l’objectif est au maximum de 4 % pour une majorité de patients) respectivement de 38 % et 43 %, chez des patients initialement engagés dans une ASG régulière, et pour des patients DT1 bien équilibrés avec une HbA1c < à 7,0 % et sans détérioration de l’équilibre glycémique. Plus récemment des données de vraie vie (rétrospectives et prospectives) ont démontré que le système Flash d’autosurveillance du glucose chez les patients DT1 et DT2 sous insulinothérapie intensifiée mais insuffisamment contrôlés en termes d’HbA1c, était associé à une réduction significative de ce paramètre métabolique [29, 30]. Ces études démontrent également une amélioration significative des scores du SF 12v2 (composante mentale) et du EQ5D 3L, une réduction des hospitalisations liées au diabète de 13,7 % à 4,7 % (p< 0,05) et de l’absentéisme au travail de 18,5 % à 7,7 % (p < 0,05).
Rappelons ici qu’il existe une corrélation forte entre ces nouveaux « metrics » de mesure du glucose par capteur de glucose (notamment le temps passé dans la cible pour Time In Range ou TIR, dont l’objectif est de 70 % entre 70 et 180 mg/dl pour une majorité de patients) et les valeurs de l’HbA1c [31, 32]. L’analyse régulière au fil de l’eau du TIR comme mesure préférée pour déterminer la qualité de l’équilibre glycémique plutôt que l’HbA1c tous les 3 - 4 mois, permet ainsi au patient comme au soignant de prédire le risque de complications du diabète et d’évaluer en continu le contrôle glycémique de chaque patient. Pour chaque variation absolue (augmentation) de 10 % du pourcentage de TIR, il y a une variation (baisse) de 0,8 % (9 mmol/mol) du taux d’HbA1c.
Réduction des événements cliniques d’importance
Les données issues d’un programme de recherche clinique effectué à partir du SNDS ont apporté, au cours des deux dernières années, des preuves manifestes de l’efficacité du système FGM (Flash glucose monitoring) sur la réduction des complications liées au diabète : il s’agit des hospitalisations pour acidocétose, des comas et hypoglycémies, de même que des hospitalisations toutes causes confondues, que ce soit auprès d’une population de patients DT1 et DT2 traités par multi-injections d’insuline33,34 ou pour des patients DT2 traités par insuline basale seule.35 Ces données viennent confirmer celles d’autres études conduites sur des durées plus courtes ou sur des critères d’évaluation moins robustes.36 Il n’existe cependant aucune étude d’intervention ayant démontré qu’en se fondant sur un objectif de temps passé dans la cible, de réduction du temps passé en hyperglycémie et/ou en hypoglycémie, en s’appuyant exclusivement sur la MCG et non sur l’HbA1c, une réduction des complications micro- et macrovasculaires liées au diabète était observée. Seules des données parcellaires ou rétrospectives apportent un début d’éclairage à cette question essentielle.
Une étude de cohorte observationnelle réalisée en Belgique de manière prospective, a été réalisée pour évaluer l'impact du remboursement national de la surveillance continue du glucose en temps réel (RT-CGM) chez 515 adultes belges atteints de DT1 et traités par pompe à insuline [37]. Cette étude publiée en 2021 a mis en évidence une relation entre la prévalence des complications liées à l’hyperglycémie chronique et le temps passé dans la cible thérapeutique (TIR [Time In Range] entre 70 et 180 mg/dl). Les personnes souffrant de complications microvasculaires étaient logiquement plus âgées et avaient une durée de diabète plus longue ainsi qu’un taux d'HbA1c plus élevé, mais elles avaient aussi un pourcentage de TIR plus faible (60,4 ± 12,2 vs 63,9 ± 13,8 %, P = 0,022) par rapport aux personnes sans complication microvasculaire. La durée du diabète et le TIR étaient des facteurs de risque indépendants de développer des complications microvasculaires multiples. Le TIR était également le seul facteur de risque indépendant pour le risque d’hospitalisations pour hypoglycémie ou acidocétose.
Une étude plus ancienne a analysé auprès de 3.262 patients atteints de DT2 la relation entre le TIR et la rétinopathie diabétique (RD) [38]. Au sein de cette population où la prévalence globale de la RD était de 23,9 %, des associations significatives ont été retrouvées entre le TIR et tous les stades de la RD (RD minime, P = 0,018 ; RD modérée, P = 0,014 ; RD sévère, P = 0,019) après ajustement sur l'âge, le sexe, l'IMC, la durée du diabète, la pression artérielle, le profil lipidique et bien sûr l'HbA1c.
Inversement, il est reconnu que l’amélioration trop rapide de l’équilibre glycémique est un facteur de risque de développement, voire d’aggravation, d’une RD non stabilisée. Mais dans un essai récent portant sur 139 patients atteints de DT1 depuis plus de cinq ans avec un déséquilibre glycémique chronique (HbA1c > à 9 %), l’amélioration de l’HbA1c, de - 2,1 % pour certains patients bons répondeurs aux changements thérapeutiques et à l’utilisation du FGM, n’a pas été associée à une majoration du risque de rétinopathie (18,7 % des patients ayant pourtant déjà bénéficié d’une panphotocoagulation rétinienne). Le FGM apparaît ici comme un élément de suivi, de sécurité et d’ajustement de l’insulinothérapie, permettant de réduire le risque hypoglycémique chez des patients initialement très déséquilibrés et d’encadrer efficacement l’intensification thérapeutique sans majoration du risque précoce de détérioration de la RD
D'autres études ont été conduites chez des patients atteints de DT2 avec une MCG professionnelle réalisée sur 3 - 6 jours ou sur des périodes prolongées. Le TIR a été retrouvé comme associé à l'épaisseur de l'intima media de la carotide dans un large échantillon de patients atteints de diabète de type 2 [39]. Dans une autre étude, le TIR est significativement et indépendamment associé à la l’artériopathie oblitérante des membres inférieurs ou avec un risque accru de mortalité toutes causes confondues et de maladies cardiovasculaires [40, 41]. Sur le plan neurologique, un TIR plus faible est associé à des symptômes de neuropathie périphérique diabétique plus marqués [42] et enfin une augmentation de 10 % du TIR est significativement et inversement corrélée à la gravité de la neuropathie autonome cardiaque, complication à haute valeur de gravité en termes de pronostic vital pour le patient [43]. Des données de mesure continue du glucose portant sur la variabilité intra- et inter-journalière du glucose sont significativement associées à la gravité de la rétinopathie diabétique et la présence d’une albuminurie, même après ajustement sur de nombreux facteurs de risque de ces complications [44].
Ainsi, sur la base de ces études, il est démontré que le temps passé dans la cible préférentielle et consensuelle (70 - 180 mg/dl pour le TIR / Time In Range) est fortement associé au risque de complications microvasculaires liées au diabète, les données sur la relation entre TIR et pathologies cardiovasculaires demeurant limitées et non concluantes. Néanmoins, tous les paramètres de la MCG devraient constituer un critère d'évaluation acceptable pour les futurs essais cliniques [45], en complément pour l’instant de l'hémoglobine A1c, mesure biologique toujours précieuse. Il y a ainsi une validation des outils modernes de surveillance du diabète par capteur de glucose au-delà de la pratique clinique, pour les essais cliniques à venir portant sur le diabète de type 1 comme de type 2 [46].
2. Haute Autorité de santé-Agence nationale de sécurité du médicament. Diabète de type 2. Stratégie médicamenteuse du contrôle glycémique du diabète de type 2. 2013. https://www.has-sante. fr/upload/docs/application/pdf/2013-02/10irp04_reco_diabete_type_2.pdf
3. Inzucchi SI, Bergenstal RM, Buse JB et al. Management of hyperglycemia in type 2 diabetes: 2015: A patientcentered approach. Update to a position statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 2015;38(1):140-9.
4. National Institute for Health and Care Excellence. Type 2 diabetes in adults: management. Nice Guideline. NG28 published: 2 December 2015.
5. Haute Autorité de santé-Agence nationale de sécurité du médicament. L’autosurveillance glycémique dans le diabète de type 2: une utilisation très ciblée. Fiche de bon usage des technologies de santé 2011.
6. International Diabetes Federation. Guideline on self-monitoring of blood glucose in non-insulin treated type 2 diabetes [internet], 2009. Available from http://www.idf.org/guidelines/self-monitoring. Accessed April 2014
7. Clar C, Barnard K, Cummins E, Royle P, Waugh N. Self-monitoring of blood glucose in type 2 diabetes: systematic review. Health Technol Assess 2010;14:1-140.
8. Sarol JN Jr, Nicodemus NA Jr, Tan KM, Grava MB. Self-monitoring of blood glucose as part of a multi-component therapy among non-insulin requiring type 2 diabetes patients: a metaanalysis (1966-2004). Curr Med Res Opin 2005;21:173-84.
9. Towfigh A, Romanova M, Weinreb JE et al. Self-monitoring of blood glucose levels in patients with type 2 diabetes mellitus not taking insulin: a meta-analysis. Am J Manag Care 2008;14:468-75.
10. Poolsup N, Suksomboon N, Rattanasookchit S. Meta-analysis of the benefits of self-monitoring of blood glucose on glycemic control in type 2 diabetes patients: an update. Diabetes Technol Ther 2009;11:775-84.
11. Farmer AJ, Perera R, Ward A, Heneghan C, Oke J, Barnett AH, et al. Meta-analysis of individual patient data in randomised trials of self monitoring of blood glucose in people with non-insulin treated type 2 diabetes. BMJ 2012; 27;344:e486. doi: 10.1136/bmj.e486
12. Polonsky WH, Fisher L, Schikman CH, Hinnen DA, Parkin CG, Jelsovsky Z, et al. Structured self-monitoring of blood glucose significantly reduces A1C levels in poorly controlled, noninsulintreated type 2 diabetes: results fromnthe Structured Testing Program study. Diabetes Care 2011;34:262-7.
13. Bosi E, Scavini M, Ceriello A, Cucinotta D, Tiengo A, Marino R, et al.; PRISMA Study Group. Intensive structured self-monitoring of blood glucose and glycemic control in noninsulin treated type 2 diabetes: the PRISMA randomized trial. Diabetes Care 2013;36:2887-94.
14. Schnell O, Barnard K, Bergenstal R, Bosi E, Garg S, Guerci B, et al. Clinical utility of SMBG: Recommendations on the use and reporting of SMBG in clinical research. Diabetes Care 2015;38:1627-33.
15. Cariou B, Fontaine P, Eschwege E, Lièvre M, Gouet D, Huet D, et al. Frequency and predictors of confirmed hypoglycaemia in type 1 and insulintreated type 2 diabetes mellitus patients in a real-life setting: results from the DIALOG study. Diabetes Metab 2015;41(2):116-25.
16. Gill GV, Woodward A, Casson IF, Weston PJ. Cardiac arrhythmia and nocturnal hypoglycaemia in type 1 diabetes--the ‘dead in bed’ syndrome revisited. Diabetologia 2009;52:42-5.
17. Stahn A, Pistrosch F, Ganz X, Teige M, Koehler C, Bornstein S, Hanefeld M. Relationship between hypoglycemic episodes and ventricular arrhythmias in patients with type 2 diabetes and cardiovascular diseases: silent hypoglycemias and silent arrhythmias.Diabetes Care 2014;37(2):516-20.
18. Rebrin K, Steil GM, Van Antwerp WP, Mastrototaro JJ. Subcutaneous glucose predicts plasma glucose independent of insulin: implications for continuous monitoring. Am J Physiol 1999;277:E561-71.
19. Benhamou PY, Catargi B, Delenne B, et al. Real-time continuous glucose monitoring (CGM) integrated into the treatment of type 1 diabetes: consensus of experts from SFD, EVADIAC and SFE. Diabetes Metab 2012;38 Suppl 4:S67-83.
20. Battelino T, Danne T, Bergenstal RM, Amiel SA, Beck R, Biester T, et al. Clinical targets for continuous glucose monitoring data interpretation: Recommendations from the International Consensus on Time in Range. Diabetes Care 2019;42(8):1593-603.
21. Free Style Libre 2, systè me Flash d’autosurveillance du glucose. Avis de la CNEDiMTS 20 octobre 2020. https://www.has sante.fr/upload/ docs/evamed/CNEDIMTS6266_ FREESTYLE%20LIBRE%202_20_ octobre_2020_(6266)_avis.pdf
22. Dexcom G6, systè me de mesure en continu du glucose interstitiel. Avis de la CNEDiMTS 25 fé vrier 2020 https://www.hassante.fr/upload/docs/evamed/CNEDIMTS-6061_DEXCOM%20G6_25_février_2020_(6061)_avis.pdf
23. FreeStyle Libre 2, systè me Flash d’autosurveillance du glucose. Modification des conditions d’inscription. Adopté par la Commission nationale d’é valuation des dispositifs médicaux et des technologies de santé le 18 octobre 2022 https://www.has-sante.fr/upload/docs/evamed/CNEDIMTS-6882_FREESTYLE%20LIBRE%202_18%20octobre%202022_(6882)_avis.pdf
24. Arrêté du 27 juillet 2023 portant inscription du système de mesure en continu du glucose interstitiel Dexcom One de la société Dexcom International Limited au titre I de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale. https://www.legifrance.gouv.fr/jorf/id/JORFTEXT000047911730
25. Arrêté du 27 juillet 2023 portant inscription du système de boucle semi fermée dédié à la gestion automatisée du diabète de type I Control-IQ de la société Tandem DiabetesCare au titre I de la liste des produits et prestations remboursables prévue à l’article L165-1 du code de la sécurité sociale. https://www.legifrance.gouv.fr/jorf/id/JORFTEXT000047911738.
26. Bolinder J, Antuna R, Geelhoed- Duijvestijn P, Kröger J, Weitgasser R. Novel glucose-sensing technology and hypoglycaemia in type 1 diabetes: a multicentre, non-masked, randomised controlled trial. Lancet 2016;388(10057):2254-63. doi: 10.1016/S0140-6736(16)31535-5.Epub 2016 Sep 12.
27. Haak T, Hanaire H, Ajjan R, Hermanns N, Riveline JP, Rayman G. Use of flash glucose-sensing technology for 12 months as a replacement for blood glucose monitoring in insulin-treated type 2 diabetes. Diabetes Ther 2017;8(3):573-86.
28. Haak T, Hanaire H, Ajjan R, Hermanns N, Riveline JP, Rayman G. Flash glucosesensing technology as a replacement for blood glucose monitoring for the management of insulin-treated type 2 diabetes: a multicenter, open-label randomized controlled trial. Diabetes Ther 2017;8(1):55-73.
29. Kröger J, Fasching P, Hanaire H. Three European retrospective real-world chart review studies to determine the e ectiveness of flash glucose monitoring on HbA1c in adults with type 2 diabetes. Diabetes Ther 2020;11(1):279-91. doi: 10.1007/s13300-019-00741-9. Epub 2019 Dec 12.
30. Fokkert M, Van Dijk P, Edens M, Barents E, Mollema J, Slingerland R, et al. Improved well-being and decreased disease burden after 1-year use of flash glucose monitoring (FLARE-NL4). BMJ Open Diabetes Res Care 2019;7(1):e000809. doi: 10.1136/bmjdrc-2019-000809. eCollection 2019.
31. Beck RW, Bergenstal RM, Cheng P, Kollman C, Carlson AL, Rodbard D, et al. The relationships between time in range, hyperglycemia metrics, and HbA1c. J Diabetes Sci Technol 2019;13(4):614-26. doi: 10.1177/1932296818822496. Epub 2019 Jan 13.
32. Vigersky RA, Mc Mahon C. The relationship of hemoglobin A1C to time-in-range in patients with diabetes. Diabetes Technol Ther 2019;21(2):81-5. doi: 10.1089/dia.2018.0310. Epub 2018 Dec 21.
33. Roussel R, Riveline JP, Vicaut E, de Pouvourville G, Detournay B, Emery C, et al. Important drop in rate of acute diabetes complications in people with type 1 or type 2 diabetes after initiation of flash glucose monitoring in France: The RELIEF Study. Diabetes Care 2021;44(6):1368-76.
34. Riveline JP, Roussel R, Vicaut E, de Pouvourville G, Detournay B, Emery C, et al. Reduced rate of acute diabetes events with flash glucose monitoring is sustained for 2 years after initiation: Extended outcomes from the RELIEF study. Diabetes Technol Ther 2022;24(9):611-8.
35. Guerci B, Roussel R, Levrat-Guillen F, Detournay B, Vicaut E, De Pouvourville G, et al. Important decrease in hospitalizationsfor acute diabetes events following FreeStyle libre system initiation in people with type 2 diabetes on basal insulin therapy in France. Diabetes Technol Ther 2023;25(1):20-30.
36. Miller E , Kerr MSD, Roberts GJ, Nabutovsky Y, Wright E. Flash CGM associated with event reduction in nonintensive diabetes therapy. Am J Manag Care 2021;27(11):e372-e377. doi: 10.37765/ajmc.2021.88780
37. El Malahi A, Van Elsen M, Charleer S et al. Relationship between time in range, glycemic variability, HbA1c, and complications in adults with type 1 diabetes mellitus. J Clin Endocrinol Metab 2022;107(2):e570-e581. doi:10.1210/clinem/dgab688.
38. Lu J, Ma X, Zhou J, Zhang L, Mo Y, Ying L et al. Association of time in range, as assessed by continuous glucose monitoring, with diabetic retinopathy in type 2 diabetes. Diabetes Care 2018;41(11):2370-6. doi: 10.2337/dc18-1131. Epub 2018 Sep 10.
39. Lu J, Ma X, Shen Y, Wu Q, Wang R, Zhang L, et al. Time in range Is associated with carotid intima-media thickness in type 2 diabetes. Diabetes Technol Ther 2020;22(2):72-8. doi: 10.1089/dia.2019.0251. Epub 2019 Oct 11.
40. Li J, Li Y, Ma W, Liu Y, Yin X, Xie C, et al. Association of time in range levels with lower extremity arterial disease in patients with type 2 diabetes. Diabetes Metab Syndr 2020;14(6):2081-5. doi: 10.1016/j.dsx.2020.09.028.Epub 2020 Sep 28.
41. Lu J, Wang C, Shen Y, Chen L, Zhang L, Cai J, et al. Time in range inrelation to all-cause and cardiovascular mortality in patients with type 2 diabetes: A prospective cohort study. Diabetes Care 2021;44(2):549-55. doi: 10.2337/dc20-1862. Epub 2020Oct 23.
42. Mayeda L, Katz R, Ahmad I, Bansal N, Batacchi Z, Hirsch IB, et al. Glucose time in range and peripheral neuropathy in type 2 diabetes mellitus and chronic kidney disease. BMJ Open Diabetes Res Care 2020;8(1):e000991. doi: 10.1136/bmjdrc-2019-000991.
43. Kim MY, Kim G, Park JY, et al. The Association between continuous glucose monitoring-derived metrics and cardiovascular autonomic neuropathy in outpatients with type 2 diabetes. Diabetes Technol Ther 2021;23(6):434-42. doi: 10.1089/dia.2020.0599. Epub 2021 Apr 5.
44. Wakasugi S, Mita T, Katakami N, OkadaY, Yoshii H, Osonoi T, et al. Associations between continuous glucose monitoring-derived metrics and diabetic retinopathy and albuminuria in patients with type 2 diabetes. BMJ Open Diabetes Res Care 2021;9(1):e001923. doi: 10.1136/bmjdrc-2020-001923.
45. Beck RW, Bergenstal RM, Riddlesworth TD, Kollman C, Li Z, Brown AS, et al. Validation of time in range as an outcome measure for diabetes clinical trials. Diabetes Care 2019;42(3):400-5. doi: 10.2337/dc18-1444. Epub 2018 Oct 23
46. Schnell O, Barnard K, Bergenstal R, Bosi E, Garg S, Guerci B, et al. Role of continuous glucose monitoring in clinical trials: Recommendations on reporting. Diabetes Technol Ther 2017;19(7):391-9. doi: 10.1089/dia.2017.0054. Epub 2017 May 22.