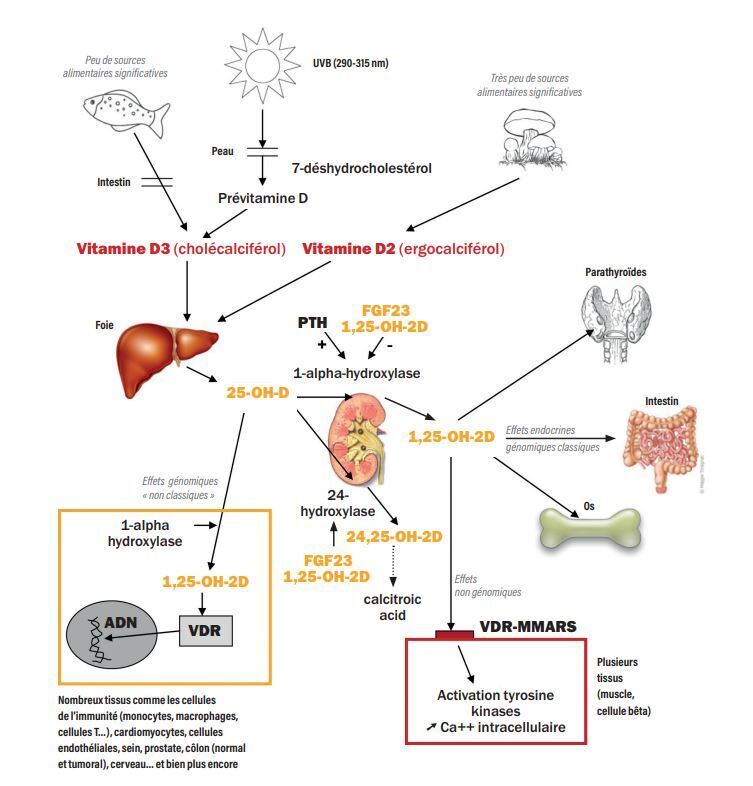
Métabolisme de la vitamine D
Quand on parle de vitamine D, on considère indifféremment la vitamine D3, ou cholécalciférol, d’origine humaine ou animale, et la vitamine D2, ou ergocalciférol, d’origine végétale. Le terme « vitamine », c’est-à-dire un produit « vital » que l’organisme ne peut pas produire et qui doit être apporté par l’alimentation, est toutefois très largement inapproprié pour la vitamine D. En effet, la peau, à partir du 7-déhydrocholestérol présent dans les couches profondes de l’épiderme, peut synthétiser de la vitamine D3 sous l’action des rayonnements UVB. Il s’agit là de la source naturelle principale de vitamine D. Les sources alimentaires de vitamine D3 sont relativement rares. Quant à celles de vitamine D2, elles sont quasiment inexistantes, à l’exception de certains champignons, en particulier lorsqu’ils sont séchés au soleil (tableau 1). Quelques aliments sont supplémentés en vitamine D mais en quantité relativement faible, et des formes pharmaceutiques ainsi que des compléments alimentaires sont disponibles.
La vitamine D (D2 ou D3) synthétisée par la peau ou absorbée, principalement dans la partie proximale de l’intestin grêle, passe dans le sang où elle est transportée par la « vitamin D-binding protein » (VDBP) jusqu’au foie où elle est hydroxylée sur le carbone 25 pour former la 25-hydroxy vitamine D (25-OH-D). Cette hydroxylation hépatique est peu régulée, et plus on ingère ou plus on synthétise de la vitamine D, plus on produit de la 25-OH-D. La demi-vie de la 25-OH-D est de l’ordre de deux à trois semaines et sa concentration sérique représente le statut vitaminique D (les réserves) d’un individu. Ceci est un consensus. Pour devenir active, la 25-OH-D doit de nouveau être hydroxylée sous l’action d’une enzyme, la 1-∞-hydroxylase, pour produire de la 1,25-dihydroxyvitamine D (1,25-OH-2D), ou calcitriol, le métabolite actif de la vitamine D, dont la demi-vie est courte (environ 4 heures). Cette seconde hydroxylation se fait classiquement dans les cellules du tubule proximal rénal, où elle est très étroitement régulée. Elle est stimulée en particulier par la parathormone (PTH) et inhibée par le facteur 23 de croissance du fi broblaste (FGF23) et le calcitriol lui-même. La 1,25-OH-2D passe dans le sang et atteint des tissus cibles où elle se lie au récepteur de la vitamine D (VDR) situé dans le cytosol des cellules de ces tissus pour exercer des effets génomiques. Ce mécanisme hormonal est la base des effets « classiques » phosphocalciques et osseux de la vitamine D. Les principaux tissus cibles « classiques » du calcitriol circulant sont la cellule intestinale où il stimule l’absorption du calcium et du phosphate, l’ostéoblaste où il stimule la synthèse de différentes protéines dont le RANKL et l’ostéocalcine, l’ostéocyte où il stimule la sécrétion de FGF23, le rein où il contrôle l’expression dans le tubule distal de la protéine TRPV5 nécessaire à la réabsorption du calcium, et les parathyroïdes où il contrôle la sécrétion de PTH.
Il existe par ailleurs une voie d’inactivation de la vitamine D via la formation de composés hydroxylés sur le carbone 24, 24,25 dihydroxyvitamine D (24,25-OH-2D) et 1,24,25 trihydroxyvitamine D (1,24,25-OH-3D) grâce à une 24-hydroxylase. L’expression de la 24-hydroxylase dans le tubule proximal est stimulée par le FGF23 et le calcitriol. Son importance a été mise en exergue avec la démonstration en 2011 que des mutations inactivatrices du gène codant pour cette enzyme (CYP24A1) étaient responsables d’une « hypersensibilité à la vitamine D » induisant une hypercalcémie sévère et une néphrocalcinose chez le nouveau-né.1 Depuis la publication de cet article princeps, plusieurs études ont montré que cette voie d’inactivation de la vitamine D correspondait à un moyen de défense que l’organisme met en jeu pour se défendre contre un excès de vitamine D.
De très nombreux tissus n’ayant rien à voir avec le métabolisme phosphocalcique et osseux expriment le VDR, la 1-alpha-hydroxylase et la 24-hydroxylase. La 25-OH-D pénètre dans ces tissus où elle est transformée en calcitriol, qui agit localement après liaison au VDR. Ce calcitriol, produit localement, ne ressort probablement pas de la cellule et ne participe donc pas au métabolisme phosphocalcique. Cette production « périphérique » de calcitriol ne semble pas régulée par les hormones calciotropes (la PTH, le FGF23…) mais dépend d’une concentration suffi sante de 25-OH-D dans le liquide extracellulaire de ces tissus. C’est la base théorique des effets génomiques « non classiques » de la vitamine D, qu’on peut qualifier d’intracrines, par opposition aux effets classiques endocrines. On considère qu’environ 3 % du génome est sous la dépendance directe ou indirecte du calcitriol. Enfin, certains effets du calcitriol mis en évidence in vitro sont tellement rapides (de l’ordre de la minute) qu’ils ne peuvent pas être dus à une action génomique. On sait maintenant que le calcitriol circulant peut exercer aussi des effets non génomiques sur certains tissus, comme la cellule musculaire lisse ou la cellule bêta du pancréas (activation de tyrosine kinases, modification du flux de calcium intracellulaire…) après liaison à des protéines membranaires dont la mieux connue est 1,25-MMARS.
La figure 1 résume les étapes principales du métabolisme de la vitamine D.
Que signifie « statut vitaminique D optimal » ?
Comme indiqué plus haut, le statut vitaminique D (tableau 2) est consensuellement défini par la concentration sérique de 25-OH-D. Cette concentration est le plus souvent exprimée en ng/mL, mais certains laboratoires l’expriment en nmol/L (1 ng/mL = 2,5 nmol/L). Dans un souci de simplification, les différents textes de ce supplément utiliseront exclusivement l’expression en ng/mL. Le mode d’établissement des valeurs de référence utilisées pour la majorité des paramètres biologiques (recruter une population apparemment en bonne santé, doser le paramètre à évaluer et définir un intervalle dans lequel on retrouve 95 % des valeurs mesurées) ne s’applique toutefois pas à la 25-OH-D. On devrait en effet définir dans ce cas (par exemple) des « normes » d’été et des « normes » d’hiver, la 25-OH-D étant, à nos latitudes, significativement plus basse en hiver qu’en été. Les experts considèrent tous qu’il faut plutôt déterminer les concentrations de 25-OH-D au-dessous et au-dessus desquelles il peut exister des effets délétères d’un manque ou d’un excès de vitamine D, ou bien les concentrations de 25-OH-D pour lesquelles on profitera au mieux des effets bénéfiques de la vitamine D en se fondant le plus possible sur les études d’intervention. On distinguera les recommandations qui concernent la population générale, c’est à-dire les sujets en bonne santé apparente, où le statut vitaminique D optimal est défi ni par une concentration de 25-OH-D de 20 à 60 ng/mL, et les patients ostéoporotiques ou à risque d’ostéoporose, les patients souffrant de malabsorption digestive, les sujets âgés « fragiles », les insuffisants rénaux chroniques pour lesquels une concentration de 25-OH-D de 30 à 60 ng/mL est privilégiée. Pour les patients atteints d’autres maladies chroniques pour lesquelles des effets bénéfi ques de la vitamine D sont suggérés, les experts sont partagés entre une concentration minimale de 20 ng/mL (comme en population générale) ou de 30 ng/ mL pour défi nir un statut vitaminique D optimal.
Quelle que soit la population considérée, une concentration de 25-OH-D < 12 ng/mL témoigne d’un déficit sévère (d’une carence) en vitamine D. Par souci de prudence, la concentration maximale de 25-OH-D à ne pas dépasser est aujourd’hui fixée à 60 ng/mL (150 nmol/L). Cette zone est en effet proche des concentrations maximales retrouvées dans des populations qui s’exposent généreusement à un soleil apportant des UVB toute l’année.2 Elle est par ailleurs suffi samment éloignée de la concentration minimale associée à une possible intoxication à la vitamine D (150 ng/mL).3 Il faut aussi souligner le fait que, dans de rares études observationnelles, la relation entre concentration de 25-OH-D et risque relatif de la maladie étudiée était représentée par une courbe en U (ou plutôt en J inversé), ce qui veut dire un risque plus élevé pour les valeurs basses, mais aussi pour les valeurs élevées, avec une élévation du risque pour des concentrations à partir de 50-60 ng/mL.4 Même si aucune relation de causalité ne peut être déduite de ce type d’études observationnelles, le principe de précaution incite à ne pas dépasser ces niveaux de 25-OH-D sérique.
On notera que plusieurs grandes études épidémiologiques ont montré qu’en population générale, environ 40 à 50 % des Français ont une concentration de 25-OH-D inférieure à 20 ng/mL (50 nmol/L) .5 Ces études épidémiologiques ont par ailleurs permis de définir très précisément les facteurs de risque d’hypovitaminose D (tableau 3).
Effets de la vitamine D : la question du niveau de preuves
De très nombreuses publications scientifiques ont abordé la question des effets de la vitamine D (près de 100 000 références sur PubMed fin 2022 en réponse à la requête « vitamin D »). Parmi ces études, nombreuses sont celles qui suggèrent que la vitamine D a possiblement des effets bénéfi ques sur de nombreuses fonctions de l’organisme, bien au-delà de ses effets classiques sur le système musculosquelettique et le métabolisme phosphocalcique. On peut séparer ces études en trois catégories principales.
Tout d’abord, les études expérimentales ou mécanistiques où, par exemple, la vitamine D ou un de ces métabolites ont été administrés à des animaux de laboratoire ou ont été mis en contact avec des cellules en culture. Les résultats de ces travaux ne sont bien sûr pas transposables à l’espèce humaine ou à l’organisme humain dans son ensemble mais peuvent expliquer le ou les mécanismes par lesquels la vitamine D pourrait agir sur telle ou telle pathologie.
On considérera ensuite les études observationnelles où l’on a étudié l’association entre la concentration de 25- OH-D ou les apports en vitamine D d’un groupe de sujets/ patients et l’incidence, la gravité ou l’évolution de telle ou telle pathologie. Une grande majorité de ces études a retrouvé une association significative entre déficit/carence en vitamine D ou faibles apports et sur-risque de nombreuses pathologies. Beaucoup d’entre elles étaient des études prospectives. « Association » ne veut toutefois pas dire « causalité », même lorsque ces études ont utilisé les méthodes d’ajustement statistiques les plus sophistiquées.
Le « juge de paix » reste bien sûr les études d’intervention, et en particulier les essais randomisés en double aveugle contre placebo. De nombreuses publications ont déjà rapporté les résultats de tels essais et il existe des méta-analyses de ces essais dans différentes situations cliniques. Le moins que l’on puisse dire est que leurs résultats sont discordants. En effet, si la supplémentation en vitamine D a fait mieux que le placebo dans certaines de ces études, beaucoup de résultats sont « neutres » (pas de différence significative entre vitamine D et placebo) et, en de très rares cas, la vitamine D a même fait pire que le placebo.
L’analyse en intention de traiter (IT) des essais d’intervention regroupés en méta-analyses conclut souvent à une absence d’effets de la vitamine D sur les cibles « non classiques » (c’est-à-dire en dehors des effets sur les fractures, les chutes et le métabolisme phosphocalcique) ou tout du moins à des effets mineurs et souvent non significatifs. L’analyse en IT, nécessaire à une évaluation fiable des médicaments selon le concept de l’evidence-based medicine, ne devrait toutefois pas obligatoirement s’appliquer systématiquement à l’évaluation des effets de la vitamine D (ou de n’importe quel autre nutriment) ou, tout du moins, devrait être adaptée. En effet, la vitamine D n’est pas vraiment un médicament ou, plutôt, n’est pas un médicament comme les autres, et de multiples différences méthodologiques entre les essais évaluant l’effet des médicaments et ceux évaluant les effets de la vitamine D peuvent potentiellement expliquer les discordances entre les résultats des différentes études d’intervention testant les effets de la vitamine D.
Les principales sont les suivantes :
- avec les médicaments « traditionnels », la concentration sanguine basale des médicaments évalués chez les sujets qui sont recrutés pour participer à une étude d’intervention est par définition égale à zéro. Si on recrute des patients pour une étude d’intervention avec de la vitamine D sans tenir compte de leur concentration circulante initiale de 25-OH-D, on peut s’attendre à ce que 50 % d’entre eux environ ne soient pas déficitaires. Ce pourcentage peut être même plus important lorsque l’étude est faite dans un pays où la concentration moyenne de 25-OH-D de la population générale est plus élevée qu’en France en raison d’une politique de supplémentation ou de fortification de certains aliments (États-Unis, par exemple) ;
- dans une méta-analyse évaluant les résultats de différents essais d’un même médicament, la dose du médicament qui est administrée est la même dans toutes les études incluses dans la méta-analyse. Dans une méta-analyse évaluant les effets de la vitamine D sur une pathologie donnée, la dose de vitamine D utilisée dans les différentes études incluses dans la méta-analyse peut varier d’un facteur 20, par exemple de 200 UI/j à 4 000 UI/j ;
- de même, dans une méta-analyse évaluant les résultats de différents essais d’un même médicament, la prise de ce médicament est temporellement la même (par exemple, une prise par jour) alors que dans une méta-analyse d’essais « vitamine D », les études incluses peuvent avoir utilisé une prise journalière, mensuelle, trimestrielle, voire annuelle. Ce point est important car l’immense majorité des études montrant des effets bénéfi ques de la vitamine D ont utilisé une supplémentation quotidienne, alors que les études où des fortes doses intermittentes ont été testées ne montrent en général pas de bénéfice de la vitamine D. Deux grandes études ayant testé l’effet d’une très forte dose (respectivement 500 000 UI per os et 300 000 UI par voie intramusculaire) de vitamine D3 administrée une fois par an pendant plusieurs années ont même retrouvé des effets délétères de la vitamine D par rapport au placebo ;
- quand on teste l’effet d’un médicament sur une pathologie, on inclut dans l’essai des patients porteurs de cette pathologie (par exemple, on teste l’effet d’un antihypertenseur chez des hypertendus). Dans certaines méta- analyses d’essais évaluant l’effet de la vitamine D sur une pathologie donnée, des études incluant des patients porteurs de ladite maladie et d’autres études n’incluant pas de tels patients ont été mélangées (voir l’exemple de l’hypertension artérielle dans l’article par M. Courbebaisse et J.-C. Souberbielle).
Les éléments ci-dessus auxquels on pourrait ajouter une durée très variable d’une étude à une autre, le fait que certaines études ont testé l’effet de la vitamine D3 et d’autres l’effet de la vitamine D2, voire d’un autre métabolite, ou le fait que certaines études ont associé la vitamine D à du calcium doivent inciter à interpréter les résultats des essais cliniques et des méta-analyses avec un certain recul. Même si l’analyse en intention de traiter reste très importante, les analyses secondaires en sous-groupes doivent à notre avis être prises largement en compte dans l’interprétation des données. Concernant les méta-analyses, une méthodologie récente dite en « IPD » (pour individual patients data) où les données individuelles de tous les patients inclus dans les essais traités dans la méta-analyse sont disponibles est devenu le gold standard. Cette méthodologie permet des analyses en sous-groupes fiables, contrairement aux méta-analyses traditionnelles.
Comme on le verra dans les chapitres qui suivent, les essais randomisés vitamine D versus placebo rapportent souvent des effets bénéfiques de la vitamine D chez des patients initialement déficitaires ou carencés en vitamine D recevant une supplémentation quotidienne, mais pas d’effet chez les patients non déficitaires (en dehors de rares situations à confi rmer). Ceci suggère que, plutôt que de considérer que la supplémentation en vitamine D réduit le risque de développer ou d’aggraver certaines pathologies, il semble plus approprié de considérer que l’hypovitaminose D est un facteur de risque indépendant pour ces pathologies. Les implications sont au moins doubles. Premièrement, en recherche, la conséquence est que les essais cliniques devraient être construits pour tester l’effet de la correction de l’hypovitaminose D versus pas de correction, plutôt que de tester l’effet de la supplémentation en vitamine D versus placebo. Les autres éléments de réflexion qui devraient être systématiquement pris en compte dans l’élaboration (ou l’interprétation) d’un essai clinique impliquant la vitamine D sont listés dans la figure 2. Deuxièmement, en pratique clinique, cette proposition peut paraître n’être qu’un élément de langage, mais elle doit avant tout inciter à éviter cette hypovitaminose D plutôt qu’espérer des bénéfices d’une supplémentation chez des sujets non défi citaires en vitamine D. On remarquera que contrairement aux principaux facteurs de risque de nombreuses maladies chroniques qui ne sont pas modifi ables (âge, comorbidités) ou qui le sont difficilement (obésité, abus d’alcool ou de tabac…), l’hypovitaminose D est, elle, très facilement modifiable par une supplémentation. Le but est donc de faire en sorte que tout le monde ait un statut vitaminique D optimal (ni trop bas ni trop haut). C’est en substance le message des articles suivants.
Cet article fait partie d'un supplément ayant bénéficié du soutien strictement institutionnel de Viatris, sans intervention de leur part dans l’élaboration du sommaire, le choix des auteurs et la rédaction des articles.
2. Luxwolda M, Kuiperst R, Kema I, Janneke Dijck-Brouwer J, Muskiet FAJ. Traditionally living populations in East Africa have a mean serum 25-hydroxyvitamin D concentration of 115 nmol/L. Br J Nutr 2012;108:1557-61.
3. Hathcock JN, Shao A, Vieth R, Vieth R, Heaney R. Risk assessment for vitamin D. Am J Clin Nutr 2007;85:6-18.
4. Stolzenberg-Solomon RZ, Jacobs EJ, Arslan AA, Qi D, Patel AV, Helzlsouer K J, et al. Circulating 25-hydroxyviatmin D and risk of pancreatic cancer: cohort consortium vitamin D pooling project of rarer cancers. Am J Epidemiol 2010;172:81-93.
5. Vernay M, Sponga M, Salanave B, Oleko A, Deschamps V, Malon A, Castetbon K . Statut en vitamine D de la population adulte en France: l’Étude nationale nutrition santé (ENNS, 2006-2007). BEH 24 avril 2012:189-94.
6. Ross C, Manson JE, Abrams S et al. The 2011 report on dietary reference intakes for calcium and vitamin D from the Institute of Medicine : what clinicians need to know. J Clin Endocrinol Metab 2011; 96: 53-58.
En collaboration avec :