Histoire contemporaine de la médecine. Il y a 400 millions d’années, le système rénine-angiotensine-aldostérone pourrait avoir permis le passage des vertébrés de la mer à la vie terrestre. Son décryptage progressif (quoique inachevé) au xxe siècle constitue, par ses retombées thérapeutiques, une des grandes avancées de la médecine moderne.
L’histoire de la rénine est une « success story » comme on aimerait en compter beaucoup en médecine. Une observation d’un physiologiste qui aboutit quelque 80 ans plus tard à l’utilisation de médicaments qui ont profondément bouleversé la thérapeutique cardiovasculaire. Nombreux sont les chercheurs qui ont rapporté une partie de son histoire.1-5 Elle est issue d’histoires individuelles de chercheurs de disciplines diverses.
Ici, l’accent est mis sur l’apport de la recherche fondamentale, depuis la découverte de la rénine et des premiers bloqueurs du système rénine jusqu’aux années 2000, date depuis laquelle les inhibiteurs du système rénine-angiotensine sont utilisés mondialement avec succès dans de nombreuses affections cardiovasculaires et rénales.
Des décennies et de multiples contributions
Il est toujours instructif d’étudier l’histoire d’une découverte. Elle amène à suivre le cheminement des chercheurs, à retrouver l’influence qu’ont exercé sur eux les idées et les concepts de leur époque. Le processus de découverte est rarement linéaire, il procède plus souvent par à-coups, avec des périodes de latence et de brutales accélérations liées aux avancées technologiques. Telle est l’histoire de la découverte du système rénine-angiotensine. Une histoire qui va au-delà de la découverte de la seule rénine puisqu’il s’agit de celle de tout un « système biologique » composé de plusieurs éléments qui participent à la régulation de l’hémodynamique cardiovasculaire et du métabolisme de l’eau et du sel.
Il a fallu plusieurs décennies pour décrypter l’ensemble des différents constituants du système rénine. La contribution de physiologistes, biochimistes, chimistes, pharmacologues, biologistes moléculaires et cliniciens-chercheurs a permis d’aboutir au schéma classique du système rénine-angiotensine tel qu’il est enseigné aujourd’hui aux étudiants et décrit dans les manuels de physiologie et de pharmacologie. C’est sur ces bases que repose l’utilisation en thérapeutique des inhibiteurs du système rénine-angiotensine. De nouveaux apports au système dit « classique » sont apparus mais ils ne seront pas discutés ici car leur contribution à l’ensemble reste encore à préciser. Notre histoire couvrira la période s’étendant de la mise en évidence initiale d’un effet hypertenseur du rein (1898) jusqu’aux années 2000 (v. tableau 1).
La préhistoire de la rénine, une découverte d’un physiologiste scandinave
La rénine a été découverte en 1898 par Robert Tigerstedt,6 un physiologiste finlandais intéressé par la circulation centrale. Il dit avoir été inspiré par les travaux de Brown-Séquard au Collège de France, qui montraient que les organes produisaient des substances actives sécrétées dans le sang et affectant la fonction de l’organisme. Le rein, pensait Tigerstedt, pourrait contrôler la pression artérielle. Il observe que l’injection d’extraits aqueux salins de rein de lapin provoque une élévation marquée et prolongée de la pression artérielle après une courte baisse initiale. Le produit presseur est seulement présent dans le cortex du rein et le sang veineux rénal, il est non dialysable, détruit par la chaleur et l’alcool, ce qui est en faveur d’une nature protéique. Tigerstedt le nomme renin, suggère qu’il peut agir sur le tonus des muscles lisses vasculaires et émet l’hypothèse que la rénine pourrait jouer un rôle dans l’hypertrophie cardiaque observée dans de nombreuses affections rénales. Cette découverte cruciale est restée pour l’essentiel ignorée pendant plus de 35 ans. La notice nécrologique de Tigerstedt (1853-1923) dans les journaux scientifiques de l’époque ne la mentionne pas.
Il est piquant de noter que cette recherche apparemment aussi triviale – injecter des broyats d’organe dans un organisme entier et en observer les conséquences – aurait du mal aujourd’hui à être subventionnée par les agences de recherche. Pourtant, l’idée simple que les produits extraits d’organes tels que le rein, le cœur et les surrénales permettent de découvrir de nouvelles hormones circulantes a été fructueuse en physiologie cardiovasculaire. Le peptide atrial natriurétique a été découvert en 1981 par DeBold à partir de broyats d’auricules cardiaques, et le peptide hypotenseur, l’adrénomédulline, par Kitamura en 1993 à partir d’injection de tissu surrénalien.
Période 1940-1970
Apport de la chirurgie expérimentale au lien entre rénine et hypertension
Ce n’est pas la fonction de la rénine que cherche Goldblatt, chirurgien et anatomo-pathologiste américain, à Cleveland, lorsqu’il crée un modèle d’hypertension expérimentale en posant un clip sur l’artère rénale d’un chien, le rein controlatéral étant enlevé. Il montre que l’ischémie du rein provoquée par la constriction de l’artère rénale génère une hypertension marquée ; il établit expérimentalement un lien entre la souffrance du rein et l’élévation de la pression artérielle.7 Ces observations rejoignent les descriptions anatomo-cliniques de Bright qui avait constaté des anomalies cardiaques chez les patients ayant une « néphrite », et ce dès les années 1835. Goldblatt suggère que l’hypertension rénovasculaire expérimentale est proche de l’hypertension humaine et qu’elle est due au relargage par le rein d’une substance hypertensive. Avec le rein ischémique, on tenait un coupable, restait à connaître son identité.
Première caractérisation biochimique et physiologique du système rénine
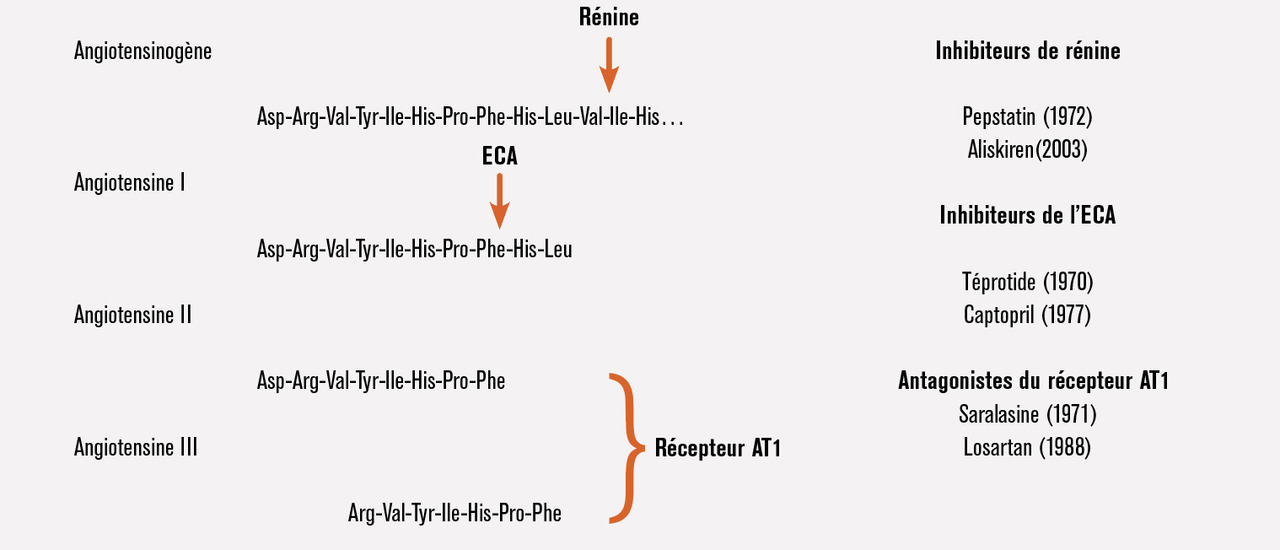
La quête pour caractériser le principe plasmatique, la rénine, responsable de l’élévation de la pression artérielle débute. Elle durera plusieurs années et impliquera la recherche d’équipes basées aux États-Unis, en Argentine et au Royaume-Uni. La rénine extraite du cortex rénal et administrée dans une préparation d’artère isolée en solution aqueuse n’est pas vasoconstrictrice par elle-même en l’absence de plasma. La rénine est une enzyme qui doit agir sur un substrat, une globuline plasmatique, pour générer une substance vasopressive, dialysable, ayant un effet hypertenseur bref mais puissant. Le produit de l’action de la rénine sur son substrat (qui sera appelé ultérieurement angiotensinogène) sera découvert en 1940 indépendamment et concomitamment par Page et Helmer aux États-Unis au Lilly Laboratory for Clinical Research à Indianapolis8 et par l’équipe de Braun Menéndez à Buenos Aires, dans l’environnement de Bernard Houssay, Prix Nobel de médecine et de physiologie.9 Le peptide hypertenseur et vasoconstricteur de huit acides aminés est appelé « hypertensine » par Braun-Menéndez et « angiotonine » par Page. Le terme « angiotensine » résulte d’un compromis entre les deux équipes et fait officiellement son entrée en 1958. L’angiotensine I est un décapeptide dont la première séquence établie chez le cheval est publiée par Elliot et Peart en 1956 au St Mary’s Hospital à Londres (fig. 1).10
Un autre chercheur contribuera de façon déterminante au décryptage de ce qui sera désormais nommé le « système rénine-angiotensine ». Skeggs travaille aussi à Cleveland (« Hypertension city » de l’époque) et isole non pas une mais deux angiotensines en 1956. Ces deux peptides sont séparés par une technique laborieuse de contre-courant à partir de 3 750 L de plasma de porc, là où aujourd’hui une simple chromatographie liquide à haute pression permettrait d’obtenir le même résultat en quelques heures. Il dénomme ces peptides angiotensine I et angiotensine II. Ils ne diffèrent que par la présence de deux acides aminés additionnels en position C-terminale pour l’angiotensine I. L’angiotensine I est inactive, seule l’angiotensine II possède des propriétés vasoconstrictrices et agit sur le cortex surrénalien. Skeggs postule l’existence d’une enzyme dépendante du chlore, capable de convertir l’angiotensine I en angiotensine II. Il la caractérise partiellement et la nomme angiotensin-I converting enzyme (enzyme de conversion de l’angiotensine I). Cette découverte ouvrira la voie à la recherche d’inhibiteurs de l’enzyme de conversion.
Skeggs a aussi purifié l’angiotensinogène de porc (à partir de 3 750 L de plasma !) et en a séquencé les 14 derniers acides aminés qui contiennent l’angiotensine I.11 Skeggs ne s’est pas contenté d’être un pionnier du système rénine. Il a inventé le principe de l’auto-analyseur colorimétrique et l’a commercialisé sous le nom de Technicon qui a permis les premiers dosages automatiques d’urée sanguine. Ses royalties lui ont sans doute permis de s’affranchir des demandes de subsides publiques pour la poursuite de ses recherches…
Plus tard, en 1970, Yang et Erdös découvrent que la bradykinine, un peptide vasodilatateur, est inactivée par une enzyme, la dipeptidyl carboxypeptidase, qui est présente dans le plasma et les cellules endothéliales.12 Cette enzyme s’avère être identique à l’enzyme de conversion de l’angiotensine I. Ainsi, la même enzyme active à la fois un système vasoconstricteur via la génération d’angiotensine II et inactive un système vasodilatateur, le système kinine-kallikréine-kinine. L’inhibition de l’enzyme de conversion de l’angiotensine bloque la formation de l’angiotensine II et en même temps potentialise l’effet vasodilatateur de la bradykinine.
Relations entre rénine, bilan sodé, rein et aldostérone
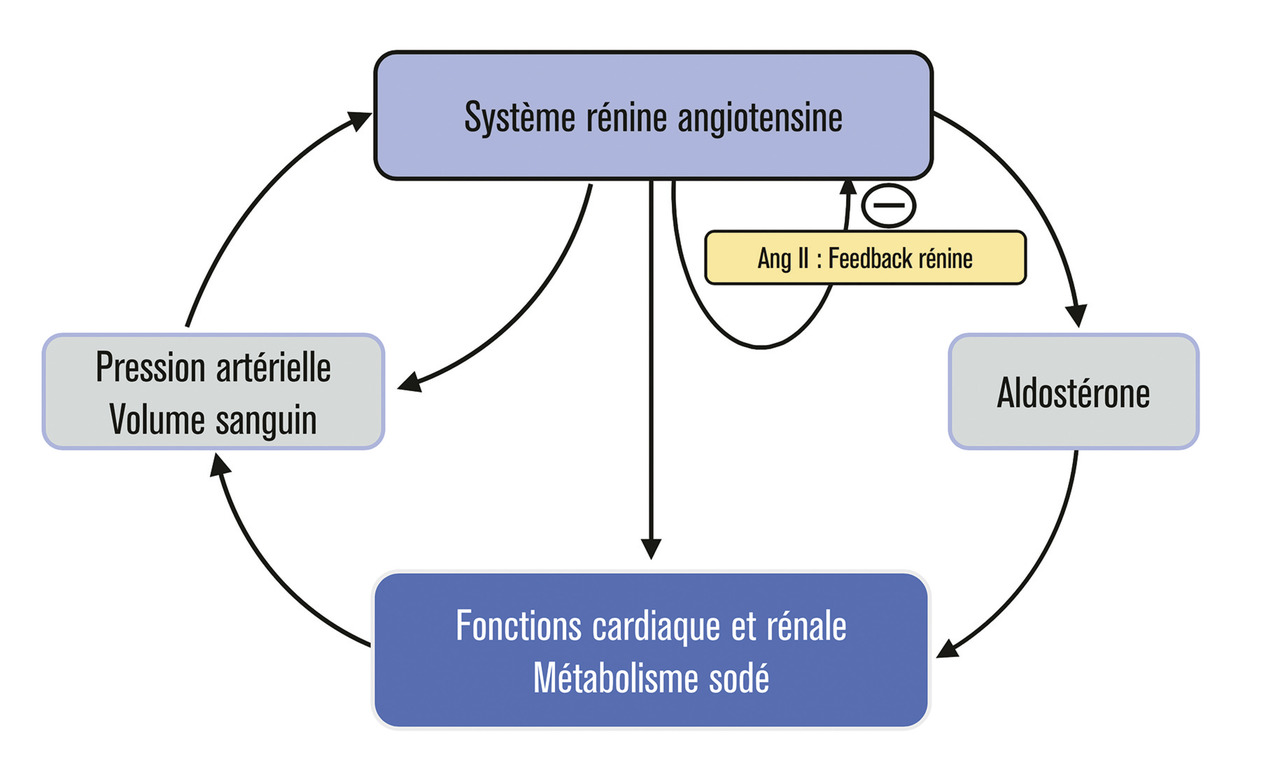
La rénine est présente dans les cellules juxtaglomérulaires rénales. Elle y a d’abord été détectée dans des granules de sécrétion par Goormaghtigh en 1939.13 L’indice de granularité des cellules juxtaglomérulaires mis au point grâce à un marqueur histochimique par Hartroft varie en fonction du bilan sodé chez le rat, suggérant un lien entre contenu en rénine du rein et bilan sodé. Ces premières observations sont confirmées en 1958 par les travaux de Gross (fig. 2) : un bilan sodé positif induit par l’administration d’un minéralocorticoïde s’accompagne d’une baisse de l’indice de granularité en rénine, et l’inverse est observé lors d’un bilan sodé négatif.14 En outre, Gross montre une relation entre le métabolisme hydrosodé et la production d’aldostérone.15 Ses travaux rejoignent ceux du physiologiste américain Davis qui dès les années 1960 avait montré par circulation croisée chez le chien qu’un facteur humoral stimulait la production d’aldostérone à partir du cortex surrénalien. Ce facteur a été identifié comme étant l’angiotensine II par les groupes de Laragh à New York et de Genest à Montréal qui montrent que la perfusion d’angiotensine II chez l’homme élève le taux d’aldostérone plasmatique. Ainsi le système rénine s’enrichit d’un nouveau partenaire, l’aldostérone, elle-même découverte en 1953, et devient le système rénine-angiotensine aldostérone dont le rôle dans l’homéostasie sodée apparaît déterminant. En 1969, Conn (pour la découverte de l’hyperaldostéronisme primaire tumoral), Genest, Gross et Laragh seront également récompensés pour cette découverte par l’attribution d’un grand prix sur l’hypertension artérielle de l’American Society of Cardiology.
La découverte de l’angiotensine II, puis sa synthèse réalisée la même année (1957) par des chercheurs académiques (Bumpus, Peart, Skeggs) et de l’industrie pharmaceutique (Schwyzer chez Ciba à Bâle) font progresser les connaissances sur les effets physiologiques du système rénine-angiotensine. L’action de l’angiotensine II est étudiée dans différentes préparations tissulaires in vitro et dans de nombreux modèles expérimentaux in vivo. Ainsi sont découvertes les multiples actions de l’angiotensine sur la régulation de la fonction rénale, la potentiation du système nerveux sympathique, la stimulation de la soif, la sécrétion de vasopressine. Le système rénine s’intègre dans l’analyse quantitative de la circulation de Guyton, qui donne au rein un rôle clé dans l’hémodynamique cardiovasculaire.16
Au début des années 1970, l’équipe de Laragh montre que le système rénine est un élément essentiel de la régulation de la pression artérielle et du bilan hydrosodé (fig. 3).17 Il mesure le taux de rénine dans l’hypertension humaine et classe les hypertendus en fonction de leur niveau de rénine plasmatique. Selon lui, la rénine pourrait être le facteur causal des hypertensions dites à « rénine haute », et son élévation serait en outre un facteur de gravité, mais ces points de vue ne font pas l’unanimité. Plusieurs mettent en doute le rôle du système rénine-angiotensine dans l’apparition et le maintien de l’hypertension essentielle, voire sa participation à l’hypertension rénovasculaire. D’autres approches que seule la mesure de la rénine dans différentes circonstances physiologiques et pathologiques s’avèrent nécessaires. De nouveaux arguments viendront des connaissances de la structure moléculaire des différents composants du système rénine-angiotensine, de la production d’anticorps monoclonaux anti-rénine permettant son identification de façon précise et du développement d’inhibiteurs spécifiques du système.
Période 1970-1980
Structure moléculaire de la rénine et des composants du système rénine
La rénine
Début 1970, on ne connaît que peu de choses sur la rénine elle-même car les tentatives de purification de cette protéine ultra-minoritaire dans le rein (la rénine ne représente que le 1/500 000e des protéines rénales) sont infructueuses. Elle est mesurée par un essai biologique en suivant l’élévation de la pression artérielle chez le rat, ce qui rend laborieux l’étude de ses variations en physiologie et en pathologie. La mise au point du dosage radio- immunologique du produit de la réaction de la rénine sur son substrat dans le plasma, l’angiotensine I, est un progrès notable car il permet de mesurer de façon simple et reproductible l’activité rénine plasmatique.18 La prochaine étape sera le dosage direct de la rénine elle-même grâce à l’obtention d’anticorps anti-rénine spécifiques.
La rénine se trouve en grande quantité dans la glande sous-maxillaire de certaines espèces de souris et y est quasi absente dans d’autres, sans qu’on en comprenne d’ailleurs la signification physiologique. En exploitant cette source extrarénale de rénine, le groupe d’Inagami à Nashville et le nôtre à Paris ont établi la structure de la rénine en utilisant des stratégies radicalement différentes.19 Inagami a isolé la rénine et séquencé pas à pas les acides aminés de la protéine selon la technique conventionnelle de Sanger. Notre unité de recherche, « Pathologie vasculaire et endocrinologie rénale » (Inserm U36), s’est appuyée sur le progrès technologique majeur de l’époque qui permet de déduire la séquence de la protéine à partir du séquençage nucléotidique de l’ADN complémentaire de son ARN messager. Si clonage et séquençage des gènes sont les techniques de base utilisées par les étudiants en master de sciences aujourd’hui, ces méthodes étaient appliquées pour la première fois à une protéine essentielle du domaine cardiovasculaire. Ultérieurement, l’unité U36 poursuivra ses travaux de recherche sur la rénine et le système rénine-angiotensine tant sur le plan de sa structure et de sa fonction que sur celui de sa régulation et de sa pharmacologie.
La rénine (v. encadré ci-contre) est synthétisée sous la forme d’une protéine inactive, la prorénine, qui contient un prosegment peptidique de 46 acides aminés situé à son extrémité N-terminale. Schématiquement, le prosegment interagit avec le site catalytique de la rénine et l’inactive. Après clivage du prosegment dans les tissus et le plasma par une enzyme dont on ignore toujours la nature exacte, la rénine est activée. Le modèle de la maturation de la prorénine en rénine a été établi en culture de cellules provenant d’une tumeur à rénine. Le clonage de la rénine a permis : d’analyser le site catalytique de l’enzyme et de montrer définitivement qu’elle appartient à la famille des aspartyl protéases (dont font aussi partie la pepsine, la cathepsine D et l’aspartyl protéase du virus de l’immunodéficience humaine [VIH]) ; de produire l’enzyme en grande quantité afin de générer des anticorps monoclonaux pour le dosage direct de la rénine active et de la prorénine ; de localiser la rénine en immunocytochimie ; de cristalliser la rénine, de la modéliser et d’établir une stratégie rationnelle pour la recherche d’inhibiteurs anti-rénine.20 Une bonne partie de ces travaux ont été réalisés en France et ont alimenté les réflexions d’un club informel, le « club rénine », qui réunissait régulièrement un biologiste moléculaire (Rougeon), un cristallographe (Mornon), un pharmacologue (Roques), un immunologiste (Pau), un médecin scientifique (Corvol) et les chimistes de Sanofi dans le but de découvrir un inhibiteur de la rénine.
Les autres composants du système rénine-angiotensine
L’élucidation de la structure moléculaire des autres composants du système rénine-angiotensine a suivi de quelques années celle de la rénine, toujours grâce aux techniques de biologie moléculaire : angiotensinogène, enzyme de conversion de l’angiotensine I et les deux récepteurs de l’angiotensine AT1 et AT2. Le récepteur AT1 est le récepteur responsable de l’ensemble des actions physiologiques dites « classiques » de l’angiotensine II ; le récepteur AT2 est exprimé principalement au cours de la vie fœtale mais sa fonction exacte est encore sujette à débat.
Période 1980-2000
Inhibiteurs du système rénine
Les premiers inhibiteurs, des peptides
Dans les années 1960-1970, les arguments physiologiques s’accumulent pour faire du système rénine-angiotensine un élément clé de la régulation du métabolisme de l’eau et du sel et de l’ajustement de la pression artérielle en fonction du bilan hydrosodé. Ils reposent sur l’établissement de relations ou de corrélations entre l’activité du système rénine-angiotensine telle qu’elle peut être mesurée à l’époque et différents types d’états physiopathologiques. Toutefois, il manque un argument direct qu’apporteront les bloqueurs du système rénine-angiotensine pour établir de façon solide le rôle de la rénine dans diverses situations physiopathologiques.
Une nouvelle classe thérapeutique d’antihypertenseurs naît, celle des inhibiteurs du système rénine- angiotensine. Elle est radicalement différente des classes déjà existantes : diurétiques, ganglioplégiques, inhibiteurs du système nerveux sympathique, antihypertenseurs centraux, vasodilatateurs, bêtabloquants. Elle est fondée sur une hypothèse physiopathologique bien spécifique, le blocage du système rénine-angiotensine. La conception des inhibiteurs résulte des connaissances sur les molécules impliquées dans la cascade de réactions enzymatiques aboutissant à la production d’angiotensine II (fig. 1). Le blocage peut se faire au niveau de la rénine ou de l’enzyme de conversion de l’angiotensine I, ou encore au niveau du récepteur AT1 de l’angiotensine II. Ce tournant de la recherche pharmacologique a demandé du temps et s’est fait progressivement, certains étant sceptiques sur l’intérêt de l’inhibition du système rénine-angiotensine ou en limitant l’indication aux hypertensions sévères à rénine haute et aux hypertensions rénovasculaires. Pourtant, Page théorise dès 1958 que « la possibilité d’agir sur la rénine, c’est-à-dire de prévenir ou de contrôler la formation d’angiotensine, ou d’agir sur l’enzyme de conversion de l’angiotensine I pour contrôler la formation d’angiotensine II mérite d’être étudiée ». Il faudra attendre le début des années 1970 pour que soit synthétisée la saralasine, le premier antagoniste peptidique du récepteur de l’angiotensine II. C’est un peptide dérivé de l’angiotensine II dont le dernier acide aminé est substitué par une alanine. La saralasine abaisse la pression artérielle dans l’hypertension rénovasculaire chez le rat, et un « test à la saralasine » est pratiqué en clinique pour savoir si une hypertension artérielle est ou non « dépendante » de la rénine. Toutefois, cet inhibiteur a l’inconvénient de mimer en partie les effets de l’angiotensine II du fait d’un effet agoniste partiel. Le test à la saralasine sous- estime la participation de la rénine au niveau tensionnel en cas de bilan sodé positif et sera abandonné.
Il était logique de penser que l’inhibition de la première étape, l’action de la rénine sur son substrat, l’angiotensinogène, serait la plus prometteuse de toutes car elle est totalement spécifique et située en amont de toute la cascade conduisant à la production des angiotensines. Elle s’avèrera en fait la plus difficile pour des raisons techniques et les premiers anti-rénine apparaîtront quelque 20 ans après les inhibiteurs de l’enzyme de conversion de l’angiotensine. Les tout premiers inhibiteurs de l’enzyme de conversion sont des peptides et leur découverte a lieu hors du champ de la rénine. L’histoire débute en 1965 par la découverte par un pharmacologue brésilien, Ferreira, de la présence de peptides hypotenseurs dans le venin d’une vipère Bothrops jararaca.21 Ces peptides inhibent l’enzyme de conversion de l’angiotensine et potentialisent le système vasodilatateur kallikréine-kinine qui était la cible étudiée par l’équipe brésilienne. Ils bloquent aussi la génération d’angiotensine II. L’un de ces peptides, le téprotide, fut utilisé en clinique et s’avérait prometteur dans les hypertensions sévères et rénovasculaires, mais du fait de sa structure peptidique il ne fut pas considéré comme une piste à suivre. Certains, comme Gross en 1974, voyaient en eux au mieux des outils de diagnostic et possiblement des agents thérapeutiques en cas d’urgence hypertensive (« Much attention is paid today to substances that interfere with the RAS. We have AngII antagonists, converting enzyme inhibitors and may expect perhaps also inhibitors of the reaction of renin with its substrate. However, all of these compounds will remain limited to diagnosis and perhaps emergency therapeutics. It is hardly to be expected that these polypeptides will form a major part of antihypertensive therapy in the future »).
L’invention du captopril
Cushman et Ondetti ont rapporté l’histoire de la conception des premiers inhibiteurs non peptidiques de l’enzyme de conversion de l’angiotensine au centre de recherche des laboratoires Squibb à Princeton, aboutissant à la fin des années 1970 à la synthèse du captopril, le premier bloqueur du système rénine-angiotensine actif par voie orale.22 La synthèse du captopril est considérée comme l’un des premiers exemples de conception rationnelle d’un médicament. Les chercheurs se sont fondés sur un modèle théorique du site actif de l’enzyme qui reposait essentiellement sur les caractéristiques enzymatiques propres de l’enzyme de conversion de l’angiotensine I comparées à celles d’autres carboxypeptidases. Ces travaux ont été conduits bien avant que la structure même de l’enzyme de conversion de l’angiotensine soit connue à la suite de son clonage en 1988 et de sa cristallisation. Grâce au captopril, on disposait du premier outil pharmacologique puissant, spécifique et de maniement facile qui permettait l’étude et le traitement de divers états physiopathologiques où le système rénine-angiotensine apparaissait intervenir chez l’animal et chez l’homme. Cushman et Ondetti reçurent le prix Lasker en 1999 pour la découverte et le développement du captopril.
De l’in vitro à l’animal puis à l’homme
Chez le sujet sain, les inhibiteurs de l’enzyme de conversion confirment que l’effet du système rénine-angiotensine dépend étroitement du bilan sodé : ce système est peu opérant en régime normosodé, tandis qu’il devient déterminant dans le contrôle de la pression artérielle en régime désodé. Les premières études relatant l’effet de l’inhibition du système rénine-angiotensine dans l’hypertension artérielle et l’insuffisance cardiaque chez l’animal et chez l’homme datent du début des années 1970. Initialement conçus comme des antihypertenseurs censés agir essentiellement dans des pathologies à rénine haute, le captopril et les inhibiteurs de l’enzyme de conversion sont d’abord prescrits à forte dose. Il s’avèrera qu’ils sont aussi efficaces dans l’hypertension essentielle tout- venant. Les inhibiteurs de l’enzyme de conversion ne peuvent pas être considérés comme des inhibiteurs totalement sélectifs du système rénine-angiotensine puisqu’ils potentialisent la bradykinine en même temps qu’ils inhibent la formation d’angiotensine II. Pour démontrer de façon certaine le rôle du système rénine, il fallait disposer d’un agent bloquant sélectivement le seul système rénine. La synthèse des inhibiteurs des récepteurs de l’angiotensine II dans les années 1990,23 puis celle plus tardive des inhibiteurs de la rénine dans les années 200024 apporteront cette preuve supplémentaire. Les résultats obtenus avec ces trois catégories d’inhibiteurs, qui agissent à des niveaux différents de la cascade du système rénine-angiotensine, sont similaires (fig. 2).
L’autre découverte d’importance est l’efficacité des inhibiteurs du système rénine-angiotensine dans plusieurs pathologies où le rôle du système rénine-angiotensine n’était pas a priori suspecté ou du moins mésestimé : l’insuffisance cardiaque congestive, le post-infarctus, la néphropathie du diabète de type 2 (tableau 2). Les inhibiteurs du système rénine-angiotensine ont transformé le pronostic de ces affections. L’une des raisons du succès des inhibiteurs du système rénine est leur bonne tolérance générale et l’absence de contre-réaction à leur effet antihypertenseur, notamment l’absence de stimulation réflexe du système nerveux sympathique et de rétention hydrosodée pouvant amenuiser leur effet.
Génétique et rénine
Il existe une composante génétique dans l’hypertension artérielle, rendant compte de 30 % de la variance du niveau tensionnel. Les premières recherches de variants génétiques du système rénine pouvant expliquer cette variance études datent de la fin des années 1980. L’hypothèse d’un rôle du gène rénine a été évaluée chez une population de patients hypertendus avec antécédents familiaux d’hypertension suivis à l’hôpital Broussais en comparant la fréquence allélique de variants du gène rénine à une population témoin normotendue, sans qu’une différence puisse être notée.25 Jeunemaitre et son équipe26 ont montré dans des hypertensions familiales sévères une relation entre le génotype de l’angiotensinogène, le taux de l’angiotensinogène plasmatique et l’hypertension artérielle, mais ces résultats prometteurs n’ont pas été retrouvés dans d’autres études. Il existe une relation entre le génotype I/D de l’enzyme de conversion de l’angiotensine I et son taux plasmatique qui est doublé chez les patients porteurs du génotype DD27 mais il n’y a pas de lien avec une élévation de la pression artérielle. Même si les études génétiques du système rénine- angiotensine ne sont pas concluantes, on ne peut pas formellement exclure une participation des gènes du système rénine-angiotensine dans certaines formes d’hypertension ou dans d’autres affections telles que la néphropathie diabétique.28
La création de souris génétiquement modifiées a apporté à la fin des années 1990 un supplément d’information sur la fonction des gènes du système rénine- angiotensine. Quel que soit le gène inactivé, on observe une baisse uniforme de la pression artérielle d’environ 35 mmHg,29 la présence d’anomalies morphologiques rénales et une fonction rénale altérée, soit un ensemble de résultats qui pouvaient être en grande partie déduits des études physiologiques et pharmacologiques du système rénine-angiotensine. Parmi les résultats inattendus, on note en l’absence de système rénine fonctionnel une anémie, suggérant que l’angiotensine II pourrait jouer un rôle dans l’hématopoïèse.30
La rénine ne manque pas de futur
Il y a dans l’histoire de la rénine (v. encadré p. 8) une certaine beauté qui tient à la logique et la rigueur avec laquelle s’est conduite la recherche et les découvertes qui en ont résulté. Elle s’est construite avec l’apport de chercheurs et de cliniciens du milieu académique et de l’industrie pharmaceutique, certains ayant pu d’ailleurs partager leurs activités entre les deux secteurs. Les inhibiteurs du système rénine-angiotensine sont une des plus grandes réussites thérapeutiques de ces trente dernières années et n’ont pas été égalés dans le domaine cardiovasculaire. Ils ont ouvert la porte à une thérapeutique dont l’efficacité a dépassé le champ même de l’hypertension. Leur succès pourrait assécher pour partie la recherche sur l’hypertension artérielle et son traitement. Les chercheurs et les cliniciens qui travaillaient de façon étroite avec l’industrie pharmaceutique sur le système rénine « classique » et le développement des inhibiteurs du système rénine-angiotensine voient tarir l’intérêt des grandes industries pharmaceutiques pour une recherche sur l’hypertension et de nouveaux antihypertenseurs, d’autant que les inhibiteurs du système rénine-angiotensine sont devenus pour la plupart des médicaments génériques. Pourtant, l’élaboration de nouvelles stratégies de blocage du système rénine- angiotensine existent, notamment au niveau central.31
L’HISTOIRE CONTINUE…
L’histoire de la rénine continue… Place aux études épidémiologiques, aux essais thérapeutiques de prévention primaire et secondaire des maladies cardiovasculaires. Le système se raffine aussi. Il serait tentant de penser qu’un siècle de recherche sur la rénine a permis de faire le tour de ses propriétés, qu’il est inutile de continuer à travailler sur un système qui a été exploré et exploité de bout en bout. Mais, chemin faisant, le schéma simple des années 2000 s’est considérablement complexifié. De nombreuses questions restent sans réponse : l’origine des cellules productrices de rénine dans le rein, la participation des gènes du système rénine-angiotensine à la génétique de l’hypertension et des maladies cardiovasculaires.
Il a fallu corriger la vue simpliste que nous avions d’une série limitée de gènes impliqués dans la régulation de la pression artérielle et l’hypertension, au premier rang desquels les gènes candidats du système rénine. L’hypertension artérielle ne fait pas exception à la complexité des maladies polygéniques et multifactorielles. Complexité aussi due à la puissance et la sensibilité des méthodes modernes de caractérisation des peptides, d’imagerie et de clonage qui ont révélé la présence et la synthèse (controversée) de rénine dans les tissus extrarénaux, l’existence d’autres angiotensines et de voies alternes de leur production. Au système rénine « classique » s’ajoutent encore d’autres enzymes et d’autres récepteurs. Leur rôle exact et leur importance restent à préciser en l’absence d’inhibiteurs spécifiques et de pathologies qui leur soient associés. Autant de sujets de recherche pour les prochaines décennies ! V
La rénine, une hormone masquée, une enzyme bâtarde ?
La rénine est une enzyme qui agit sur un substrat et un seul, l’angiotensinogène, ce qui en soi est inhabituel car les enzymes de la famille des protéases acides clivent de nombreux substrats. La rénine est synthétisée sous la forme d’une proenzyme inactive, la prorénine, et est activée en rénine par clivage d’un prosegment N-terminal de façon similaire au mécanisme mis en jeu lors de l’activation des prohormones en hormone active. La rénine est produite, maturée et sécrétée dans des cellules rénales très particulières, les cellules juxtaglomérulaires, situées dans la média des artères rénales. Ces cellules contiennent à la fois des grains de sécrétion de rénine et des myofibrilles, signant un double caractère de cellule endocrine et de cellule musculaire lisse vasculaire. La prorénine stockée dans les grains de sécrétion des cellules juxtaglomérulaires est activée et sécrétée en fonction des besoins de l’organisme sous l’effet de divers stimulus (hypovolémie, système nerveux sympathique…). Sa production est freinée lors du rétablissement de l’homéostasie hydrosodée ou du niveau de la pression artérielle. L’angiotensine II, le produit de son activité enzymatique, freine la production de rénine au niveau des cellules juxtaglomérulaires (feedback rétroactif direct [fig. 3]), un type de mécanisme aussi observé dans des cellules endocrines.Il existe une forme très rare d’hypertension artérielle sévère, due à une tumeur à rénine qui se développe à partir des cellules juxtaglomérulaires. La tumeur est bénigne, l’hypertension traitable par des bloqueurs du système rénine et guérissable de façon définitive par exérèse de la tumeur. Les tumeurs à rénine sont précieuses pour l’étude de la production de rénine et sa maturation en rénine active en culture cellulaire. L’ensemble de ces données, totalement inhabituelles pour une enzyme banale, amène à considérer que la rénine partage plusieurs des caractéristiques d’une hormone, qu’elle est en quelque sorte une « enzyme bâtarde ».
1. Galen FX, Devaux C, Houot AM, et al. Renin biosynthesis by human tumoral juxtaglomerular cells. Evidence for a renin precursor. J Clin Invest 1984;73:1144-55.
L’émergence du système rénine, une histoire de 400 millions d’années
Le système rénine-angiotensine-aldostérone est l’un des systèmes les plus importants de régulation de la volémie et du bilan hydrosodé. Il pourrait avoir été opérationnel très tôt dans l’évolution des vertébrés. Le passage de la vie aquatique à la vie terrestre a requis le développement de puissants mécanismes de rétention de l’eau et du sel. Parmi ceux-ci, la construction d’un système rénine-angiotensine-aldostérone fonctionnel peut avoir été un élément essentiel de l’adaptation à la vie terrestre qui s’est produite il y a 395 à 360 millions d’années. Tous les constituants essentiels du système rénine-angiotensine, rénine, angiotensinogène, enzyme de conversion de l’angiotensine I et récepteurs de l’angiotensine II, étaient présents au cours du paléozoïque, il y a près de 400 millions d’années. Les gènes du système rénine-angiotensine ont été caractérisés par leur homologie de séquence ADN avec celle observée aujourd’hui. L’angiotensine II exerce une action vasoconstrictrice et hypertensive dans toutes les espèces de vertébrés étudiés, elle stimule le système nerveux sympathique et induit la soif au niveau central. Elle exerce une action directe sur la fonction rénale et augmente la production de minéralocorticoïdes, d’aldostérone ou de corticostérone, selon les espèces. Les différents composants du système rénine proviennent de gènes ancestraux et ont conservé certaines propriétés de leur superfamilles fondatrices. Ainsi, la rénine appartient à la famille des aspartyl-protéases dont fait aussi partie l’aspartyl-protéase du VIH. Celle-ci partage avec la rénine le même site catalytique, et les premiers inhibiteurs de cette protéase ont été conçus à partir d’inhibiteurs de la rénine. Certains gènes du système rénine-angiotensine préexistent à la période du paléozoïque alors même qu’il n’y a pas de système rénine constitué. C’est, par exemple le cas de l’enzyme de conversion qui est présente chez certaines bactéries, chez les annélides et la drosophile. Ces espèces sont dépourvues des autres éléments du système rénine, mais l’enzyme de conversion chez ces espèces possède déjà plusieurs des caractéristiques de l’enzyme de conversion de l’angiotensine I des mammifères : il hydrolyse l’angiotensine et est inhibé par le captopril. Il joue un rôle dans la digestion finale des protéines, la morphogenèse et la reproduction.
1. Corvol P, Elghozi JL. Sortir de l’eau : de la vie aquatique à la vie terrestre. Paris : Odile Jacob, 2011.
Débats et controverses
La rénine est-elle la cause de l’hypertension artérielle ?
La discussion dure depuis des décennies. La seule hypertension artérielle purement dépendante de la rénine est l’exceptionnelle tumeur à rénine dont l’exérèse guérit le patient. L’hypertension rénovasculaire dépend de la production de rénine et du bilan sodé, elle est ainsi partiellement dépendante de la rénine. Un taux élevé de rénine plasmatique, une bonne réponse aux inhibiteurs du système rénine-angiotensine ne sont pas des arguments suffisants pour faire de la rénine un facteur causal d’hypertension essentielle. Il est difficile de répondre à la question car l’activation du système rénine ne peut s’interpréter qu’en fonction du bilan sodé, lui-même particulièrement difficile à évaluer. L’hypertension essentielle pourrait-elle être due à une sécrétion inappropriée de rénine en regard de la balance hydrosodée ? L’hypothèse émise par Ménard dès 1967 reste séduisante.1
Peut-on prévoir la réponse aux inhibiteurs du système rénine-angiotensine chez les patients hypertendus ?
À première vue, le système rénine-angiotensine présente plusieurs caractéristiques qui en font un bon candidat pour prédire chez un hypertendu la réponse à un inhibiteur de l’enzyme de conversion, un antagoniste du récepteur de l’angiotensine ou un antirénine. Trois approches ont été entreprises :– le dosage de la rénine plasmatique rapportée au métabolisme sodé, apprécié sommairement par l’excrétion urinaire de Na+, a amené Laragh et son équipe à classer les hypertensions essentielles en rénine haute, normale ou basse et à proposer un traitement en conséquence dans les années 1970 : inhibiteurs du système rénine-angiotensine pour les hypertensions à rénine haute/normale et diurétiques pour les hypertensions à rénine basse ;– des tests aigus de blocage pharmacologique du système rénine-angiotensine (tests à la saralasine – antagoniste de l’angiotensine II et au téprotide – inhibiteur de l’enzyme de conversion de l’angiotensine I) ont cherché à corréler la baisse de la pression artérielle à celle observée en traitement chronique ; – il est logique de penser que la réponse aux inhibiteurs spécifiques du système rénine- angiotensine pourrait être corrélée à l’un des génotypes du système rénine-angiotensine.Déception : le dosage de la rénine dans l’hypertension essentielle, le profilage rénine et les tests aigus d’inhibition du système rénine-angiotensine n’ont pas tenu leurs promesses après avoir été source de nombreuses controverses. Les études cherchant une corrélation entre le génotype des composants du système rénine-angiotensine et la baisse de la pression artérielle ne sont pas non plus concluantes ; elles ne permettent pas aujourd’hui de prédire au niveau individuel la réponse d’un patient à l’un ou l’autre des inhibiteurs du système rénine-angiotensine. Un taux élevé de rénine plasmatique, contrairement à ce qu’avait écrit Laragh, n’est pas un facteur certain de mauvais pronostic. Nous sommes encore loin d’une médecine de précision !
Peut-on vivre sans rénine ?
En 1980, Brunner et Gavras posaient la question de la nécessité du système rénine. Elle méritait d’être traitée au moment où se développaient le captopril et les inhibiteurs de l’enzyme de conversion3 car ils observaient d’un côté des effets secondaires sur la fonction rénale en cas de fonction rénale préalablement altérée et de l’autre la quasi-absence d’effets sur la pression artérielle chez des patients sains en régime normosodé. Ils concluaient au rôle indispensable de la rénine dans les états de déplétion sodée importante, d’insuffisance cardiaque congestive et de choc. La même conclusion s’applique aujourd’hui. Le système rénine n’est pas indispensable chez le sujet sain en présence d’un apport sodé habituel mais devient vital en cas de déplétion sodée majeure pour préserver l’hémodynamique générale et au premier chef la fonction rénale. Par ailleurs, le système rénine-angiotensine est indispensable au développement embryonnaire, comme le faisaient suspecter les effets délétères de la prise d’inhibiteur de l’enzyme de conversion au cours de la grossesse.4 Une pathologie autosomale récessive rare, la dysgénésie tubulaire rénale, est due à un inactivation bi-allélique de l’un des quatre gènes du système rénine classique.5 Elle entraîne un hydramnios, une anurie chez le fœtus et le décès néonatal ou périnatal. Elle montre l’importance du système rénine au cours du développement de l’embryon et révèle qu’il n’y a pas de système physiologique capable de suppléer le système rénine.
1. Ménard J, Meyer Ph, Milliez P. L’hypertension d’origine rénale : une sécrétion inappropriée de rénine. Presse Med 1967;75:2083-5.
2. Laragh JH, Sealey JE. Renin system understanding for analysis and treatment of hypertensive patients. In: Hypertension. Pathophysiology, Diagnosis and Management. Laragh JH and Brenner BM ed. New York:Raven Press, 1995:1813-36.
3. Brunner HR, Gavras H. Is the renin system necessary? Am J Med 1980;69:739-45.
4. Barr M. Teratogen update: angiotensin-converting enzyme inhibitors. Teratology 2018;50:399-409.
5. Gribouval O, Gonzales M, Neuhaus T, et al. Mutations in the renin angiotensin system are associated with autosomal recessive renal tubular dysgenesis. Nature Genet 2005;37:964-68
1. Skeggs LT. Historical overview of the renin-angiotensin system. In Hypertension and the angiotensin system. Doyle AJ and Beam AG ed. New York: Raven Press, 1983:31-44.
2. Page IH. Hypertension Research. A Memoir 1920-1960. New York: Pergamon Press, 1988.
3. Robertson JIS. Renin and angiotensin: a historical review. in The renin angiotensin system, ed JIS Robertson and MG Nicholls. Londres: Gower Medical Publishing Group, 1993:1.1-1.17.
4. Ménard J. Anthology of the renin-angiotensin system: a one hundred reference approach to angiotensin II antagonists. J Hypertension 1993;11(suppl 3):S3-S11.
5. Postel-Vinay N. La découverte du système rénine-angiotensine In Impressions artérielles. Paris : Maloine, 1995:79-90.
6. Tigerstedt R, Bergman PG. Niere und kreislauf. Scand Arch Physiol1898;8:223-71.
7. Goldblatt H, Lynch J, Hanzal RF, et al. The production of persistent elevation of systolic blood pressure by means of renal ischemia. J Exp Med 1934;59:347-80.
8. Page IH, Helmer OM. A crystalline substance resulting from the action between renin and renin-activator. J Exp Med 1940;71:29-42.
9. Braun-Menéndez E, Fasciolo JC, Leloir LF, et al. The substance causing renal hypertension. J Physiol 1940;98:283-98.
10. Elliot DF, Peart WS. Amino acid sequence in a hypertensin. Nature 1956;177:527-8.
11. Skeggs LT, Kahn JR, Lentz KE et al. The preparation, purification and aminoacid sequence of a polypeptide renin substrate. J Exp Med 1957;106:439-53.
12. Yang HYT, Erdös EG, Levin Y. A dipeptidyl carboxypeptidase converts angiotensin I and inactivates bradykinin. Biochem Biophys Acta 1970;214:374-6.
13. Goormaghtigh N. La fonction endocrine des artères rénales : son rôle dans la pathogénie de l’hypertension artérielle. Rev Belge Sci Med 1945;16:65-155.
14. Gross F, Lichtlen P. Experimental renal hypertension: renin content of kidneys extracts in intact and adrenalectomized rats given cortexone. Am J Physiol 1958;195:543-8.
15. Gross F, Schaechtelin G, Brunner H, et al. The role of the renin-angiotensin system in blood pressure regulation and kidney function. Canad Med Ass J 1964;90:258-62.
16. Guyton AC, Hall JE, Coleman TC, et al. The dominant role of the kidney in long-term arterial pressure regulation in normal and hypertensive states. In: Hypertension. Pathophysiology, Diagnosis and Management. Laragh JH and Brenner BM Ed. New York: Raven Press, 1995:1311-26.
17. Laragh JH, Baer L, Brunner HR, et al. Renin, angiotensin and aldosterone system in pathogenesis and management of hypertensive vascular diseases. Am J Med 1972;52:633-52.
18. Haber E, Koerner T, Page LB, et al. Application of a radioimmunoassay for angiotensin I to the physiological measurement of plasma renin activity in normal human subjects. J Clin Endoc Metab 1969; 29:1349-55.
19. Corvol P, Ménard J. Renin purification and cloning. Hypertension 1991;18:252-6.
20. Corvol P, Menard J. De la structure de la rénine à la conception d’inhibiteurs. Med Sci 1986;2:385-94.
21. Ferreira SH. A bradykinin-potentiating factor (BPF) present in the venom of Bothrops Jararaca. Br J Pharmacol Ther 1965;24:163-9.
22. Cushman DW, Ondetti MA. History of the design of captopril and related inhibitors of angiotensin converting enzyme. Hypertension 1991;17:589-92.
23. Wong PC, Chiu AT, Price WA, et al. Nonpeptide angiotensin II receptor antagonists. J Pharmacol Exp Ther 1988;247:1-17.
24. Wood J, Malbaum J, Rahuel J, et al. Structure-based design of aliskiren, a novel orally active renin inhibitor. Biochem Biophys Res Commun 2003;308:698-705.
25. Soubrier F, Jeunemaitre X, Rigat B, et al. Similar frequencies of renin gene restriction fragment length polymorphism in hypertensives and normotensive subjects. Hypertension 1990;16:712-7.
26. Jeunemaitre X, Soubrier F, Koteletsev Y, et al. Molecular basis of essential hypertension: role of angiotensinogen. Cell 1992;71:169-80.
27. Rigat B, Hubert C, Alhenc-Gelas F, et al. An insertion/deletion polymorphism in the angiotensin I-converting enzyme accounts for half the variance of serum enzyme levels. J Clin Invest 1990;86:1343-6.
28. Marre M, Hadjadj S, Bouhanick B. Hereditary factors in the development of diabetic renal disease. Diabetes Metab 2000;26(Suppl 4):30-6.
29. Krege JH, John SW, Langenbach LL, et al. Male-female differences in fertility and blood pressure in ACE-deficient mice. Nature 1995;375:146-8.
30. Cole J, Ertoy D, Lin H, et al. Lack of angiotensin II-facilitated erythropoiesis causes anemia in angiotensin-converting enzyme-deficient mice. J Clin Invest 2000;106:1391-8.
31. Marc Y, Hmazzou R, Balavoine F, et al. Central antihypertensive effects of chronic treatment with RB150 : an orally active aminopeptidase A inhibitor in deoxycorticosterone acetate-salt rats. J Hypertension 2018;36:641-50.
Une question, un commentaire ?

 Encadrés
Encadrés