Les patients vivant avec une transplantation d’organe sont de plus en plus nombreux, et ont vu leur espérance de vie s’allonger grâce aux progrès en matière de technique de transplantation d’organes et d’immunosuppression. Cependant, le traitement immunosuppresseur expose à un risque accru de cancers cutanés. Plus de 1 patient sur 2 présentera un carcinome cutané après vingt ans de greffe. Ces cancers cutanés, notamment les carcinomes épidermoïdes cutanés (CEC), peuvent avoir une évolution plus péjorative chez les patients greffés d’organes (GO), avec un risque de métastases et de mortalité plus important que dans la population générale. Le suivi dermatologique régulier, avec dépistage et traitement précoce de ces carcinomes, est donc essentiel.
Les carcinomes cutanés
Épidémiologie
Les carcinomes représentent plus de 90 % des cancers cutanés après la transplantation. Leur incidence augmente avec la durée de l’immunosuppression. Elle atteint plus de 50 % des patients après vingt ans de greffe1.
Chez les patients GO, les CEC sont prépondérants, avec une incidence multipliée par 100 (entre 65 et 250 selon les séries), alors que l’incidence des carcinomes basocellulaires (CBC) est multiplié par 10. Le rapport CBC/CEC, qui est de 4/1 dans la population générale, est ainsi inversé chez les patients greffés. Le risque augmente de façon exponentielle pour les CEC et linéaire pour les CBC.
Dans une étude de registre récente, il a été montré une diminution de l’incidence des CEC et des CBC, sans modification du ratio CBC/CEC, en comparant les SIR (standardized incidence ratio) : rapports standardisés d’incidence de 1994-1996 et ceux de 2012-2014, probablement en lien avec une modification des stratégies immunosuppressives2. Les premiers carcinomes surviennent classiquement dans les sept à huit ans après la transplantation. Ce délai est raccourci chez les patients à risque, c’est-à-dire âgés de plus de 60 ans et de phototype clair, et est de deux à trois ans1.
Après un premier carcinome, le risque de survenue d’un nouveau carcinome est de 70 à 100 % dans les cinq ans, en l’absence de modification du traitement immuno-suppresseur3.
Facteurs de risque de carcinomes cutanés
Plusieurs facteurs de risque ont été identifiés. On distingue les facteurs de risque intrinsèques : l’âge élevé, le sexe masculin, le phototype clair, l’exposition solaire et les antécédents de cancers cutanés avant la greffe. Les facteurs de risque extrinsèques sont essentiellement la durée et l’intensité des traitements immunosuppresseurs4. Leur rôle dans la survenue des carcinomes a largement été étudié (voir le chapitre « Physiopathologie »). L’incidence des carcinomes est parallèle à l’intensité de l’immunosuppression et sera donc plus forte chez des patients très immunodéprimés, comme lors du traitement d’un épisode de rejet1. Ainsi, les patients greffés cardiaques et pulmonaires sont les plus à risque de développer un cancer cutané4. À l’inverse, les patients greffés hépatiques, souvent moins immunodéprimés, ont un risque moindre de développer des cancers cutanés4.
La mauvaise compatibilité HLA a également été rapportée comme favorisant les cancers cutanés1.
Certaines séries ont montré une association entre cancers cutanés et pathologie initiale comme la polykystose rénale et la maladie cholestatique hépatique.
Le traitement par voriconazole, couramment prescrit en traitement curatif et prophylactique des infections fongiques invasives, est associé à un sur-risque de carcinomes épidermoïdes multiples et agressifs, notamment chez des patients prédisposés5.
Physiopathologie
La physiopathologie des carcinomes cutanés chez les patients GO met en jeu une interaction complexe entre plusieurs facteurs, l’immunosuppression, l’action spécifique de certaines molécules indépendamment de l’immunosuppression, l’exposition aux ultraviolets (UV) et le papillomavirus humain (HPV) pour les CEC.
L’exposition aux ultraviolets induit une immunodépression locale et systémique. Cette exposition combinée à l’immunosuppression chronique des patients GO induit une capacité réduite à la surveillance tumorale médiée immunologiquement et donc à un risque accru de cancers cutanés.
Les patients GO sont plus sensibles aux virus oncogènes que la population générale. La physiopathologie, et donc l’incidence des CEC et des CBC, diffèrent notamment du fait du rôle de l’HPV dans la genèse du CEC, alors qu’il n’y a pas d’association entre HPV et CBC6. Certains sous-types de bêta-HPV comme HPV5, HPV8 et HPV9, souvent considérés comme non pathogènes, pourraient jouer un rôle physiopathologique en bloquant la voie Notch et en interagissant avec la réparation de l’ADN et l’apoptose induites par les irradiations6. Par ailleurs, la protéine E6 de l’HPV cible la protéine Bak induisant une dégradation protéique conduisant à un blocage de la réponse apoptotique p536. En revanche, il n’a jamais été détecté d’ARN d’HPV dans les CEC des patients GO ou non immunodéprimés, ce qui signifie qu’une réplication virale continue n’est pas nécessaire au développement du CEC6.
Par ailleurs, les GO présentent également un risque accru de carcinogenèse par interaction directe d’agents immunosuppresseurs sur l’initiation et la promotion des cancers de la peau. La ciclosporine entraîne une résistance à l’apoptose induite par les UV dans les kératinocytes. Ce mécanisme de résistance à l’apoptose n’a pas été retrouvé avec le tacrolimus6, qui a montré un risque relatif moindre de cancer cutané comparé à la ciclo-sporine6. Par ailleurs, la ciclosporine favoriserait le développement et l’invasion tumorale par la production de facteurs de croissance comme le TGFb6.
Les tumeurs in situ (TIS) sont également responsables d’un risque accru d’effets carcinogènes induits par les UV. L’azathioprine entraîne une photosensibilité de l’ADN aux UVA responsable d’effets mutagènes et d’une augmentation du risque de carcinomes épidermoïdes7.
Par ailleurs, les patients GO traités avec l’azathioprine présentent des mutations plus fréquentes dans le gène codant p53, comparés aux patients immunocompétents atteints de carcinomes cutanés6.
Caractéristiques cliniques
Les carcinomes siègent essentiellement sur les zones photo--exposées (visage, cuir chevelu, oreilles, dos des mains, avant-bras, tibias et décolleté chez les femmes).
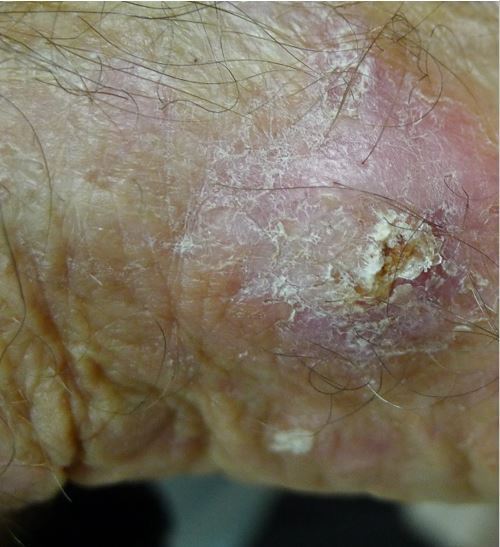
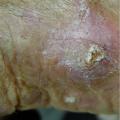
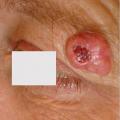
Le CEC est souvent précédé et/ou associé à une lésion de kératose actinique et/ou à une maladie de Bowen (CEC in situ). L’aspect clinique d’une kératose actinique et d’une maladie de Bowen est celui d’une lésion kératosique peu ou pas infiltrée. L’aspect du CEC est celui d’une lésion kératosique infiltrée (figure 1) unique ou multiple au sein d’un champ de cancérisation. La douleur est un bon signe prédictif de CEC au sein d’un champ de cancérisation. Le CEC prend fréquemment un aspect clinique trompeur chez les patients immunodéprimés, imposant au moindre doute d’effectuer des biopsies, notamment en cas de lésion résistante aux traitements destructeurs simples. Il peut être d’apparition très rapide, nécessitant une prise en charge chirurgicale urgente, idéalement dans les quinze jours. Le CBC prend classiquement l’aspect d’une lésion perlée, papule arrondie translucide et télangiectasique qui s’étale progressivement (figure 2). Elle peut s’ulcérer et/ou être pigmentée.
Pronostic des carcinomes chez les patients GO
Les CEC sont considérés classiquement comme plus agressifs après greffe d’organe, avec un taux de métastases et de récidives locales non négligeable (de l’ordre de 5-8 % et 12 % respectivement)1. Les facteurs de risque classiques de métastases dans la population générale sont essentiellement un diamètre supérieur à 2 cm, la présence d’une invasion périnerveuse, le caractère peu ou pas différencié et une invasion en profondeur au-delà de l’hypoderme. Chez les patients GO, l’aspect histologique des CEC est plus souvent peu différencié que dans la population générale6. Par ailleurs, ces facteurs de risque de métastases semblent différents chez les patients GO. Dans une étude rétrospective de 134 patients GO, la majorité des CEC métastatiques étaient de diamètre inférieur à 2 cm, alors que dans la population immunocompétente contrôle, le diamètre et l’épaisseur de la tumeur étaient retrouvés comme facteurs de risque de métastases8. Une étude européenne prospective tente actuellement de mieux préciser le pronostic et les facteurs de risque des carcinomes épidermoïdes chez le GO.
Concernant le CBC, son pronostic ne semble pas plus péjoratif chez les patients greffés.
Les mélanomes
Le mélanome est une tumeur développée aux dépens des mélanocytes. Il est plus agressif que les carcinomes cutanés, et est responsable de la grande majorité des décès par cancers cutanés dans la population générale. C’est un cancer particulièrement immunogénique, qui est donc favorisé par l’immunosuppression. Il reste cependant moins fréquent que les carcinomes cutanés. Après greffe d’organe, le risque de développer un mélanome est multiplié par 2 à 5 selon les études. Le pronostic du mélanome apparaît plus péjoratif chez les transplantés, avec un risque de mortalité lié au mélanome multiplié par 2 à 3. Ceci est affirmé pour les mélanomes diagnostiqués aux stades les plus avancés (stades T3, T4), comme l’a montré une étude collaborative européenne9. En revanche, les données sont moins unanimes pour les mélanomes de faible épaisseur, certaines équipes rapportant un risque égal à la population générale10, là où d’autres rapportent une mortalité accrue. L’azathioprine a été identifiée comme un facteur de risque supplémentaire dans une étude récente7.
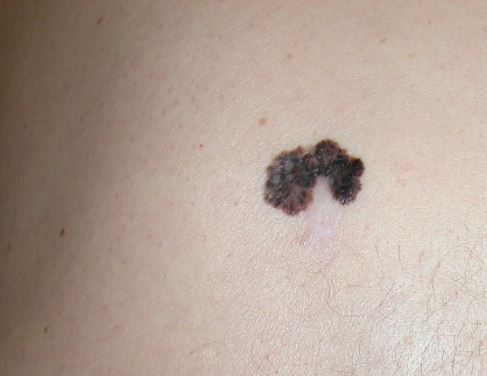
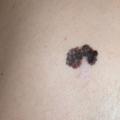
Le diagnostic doit être évoqué devant toute lésion pigmentée suspecte à l’examen clinique et dermoscopique, en particulier chez un sujet de phototype clair (figure 3).
Modalités de suivi dermatologique des patients GO
Les recommandations préconisent un suivi dermatologique annuel après la transplantation. En cas de survenue d’un CBC, d’une kératose actinique ou d’une maladie de Bowen, la surveillance doit être renforcée, avec une consultation semestrielle. Après un CEC, ou en cas de nombreux CBC, ou de nombreuses kératoses actiniques et/ou de maladie de Bowen notamment dans le cadre d’un champ de cancérisation, le suivi doit être trimestriel. Après un CEC agressif, c’est-à-dire un CEC récidivant ou métastatique, ce suivi peut encore être rapproché à tous les mois ou deux mois. Le suivi après carcinome est essentiellement clinique. Un suivi par imagerie est recommandé en cas de présence de facteurs de risque de CEC métastatique, par scanner ou échographie, tous les quatre à six mois. Un suivi par imagerie par résonance magnétique peut être intéressant en cas de CEC neurotrope.
La stratégie de surveillance après mélanome doit suivre les recommandations de la population immunocompétente.
Conclusion
Les patients GO ont un risque multiplié par 100 de développer un CEC. L’aspect clinique du CEC est celui d’une lésion kératosique infiltrée, parfois douloureuse, qui peut fréquemment prendre un aspect trompeur, imposant une biopsie au moindre doute. Certains CEC ont une évolution très rapide, nécessitant une prise en charge chirurgicale urgente. Leur pronostic semble plus péjoratif que dans la population générale. Le risque de développer un CBC est multiplié par 10 chez les patients GO. L’aspect du CBC est celui d’une lésion perlée. Son pronostic est le même que dans la population générale. Le risque de développer un mélanome est multiplié par 2 à 5 chez le patient GO. L’aspect est celui d’une lésion pigmentée atypique. Son pronostic semble plus péjoratif que dans la population générale, notamment pour les mélanomes de stade avancé. Le suivi dermatologique du patient GO doit être au minimum annuel et plus rapproché en cas de survenue de carcinomes ou mélanomes.
Cet article fait partie d'un supplément ayant bénéficié du soutien strictement institutionnel de Galderma, sans intervention de leur part dans l’élaboration du sommaire, le choix des auteurs et la rédaction des articles.
1. Euvrard S, Kanitakis J, Claudy A, Skin cancers after organ transplantation. N Engl J Med 2003;348:1681-91.
2. Menzies S, O’Leary E , Callaghan G, Galligan M, Deady S, Gadallah B, et al. Declining incidence of keratinocyte carcinoma in organ transplant recipients. Br J Dermatol 2019 Nov;181(5):983-91.
3. Euvrard S, Kanitakis J, Claudy A. Subsequent skin cancers in kidney and heart transplant recipients after the first squamous cell carcinoma. Transplantation 2006 Apr 27;81(8):1093-100.
4. Gibson JAG, Cordaro A, DobbsTD, Wormald JCR, Trickett RW, Harrison CJ, et al. The association between immunosuppression and skin cancer in solid organ transplant recipients: a control-matched cohort study of 2,852 patients. Eur J Dermatol 2021 Dec 1;31(6):712-21.
5. Williams K, Mansh M, Chin-Hong P, Singer J, Arron ST. Voriconazole-associated cutaneous malignancy: a literature review on photocarcinogenesis in organ transplant recipients. Clin Infect Dis 2014 Apr;58(7):997-1002.
6. Mittal A, Colegio OR. Skin cancers in organ transplant recipients. Am J Transplant 2017 Oct;17(10):2509-30.
7. Jiyad Z, Olsen CM, Burke MT, Isbel NM, Green AC. Azathioprine and risk of skin cancer in organ transplant recipients: Systematic review and meta-analysis. Am J Transplant 2016 Dec;16(12):3490-503.
8. Genders RE, Osinga JAJ, Tromp EE, O’Rourke P, Bouwes Bavinck JN, Plasmeijer EI. Metastasis risk of cutaneous squamous cell carcinoma in organ transplant recipients and immunocompetent patients. Acta Derm Venereol 2018 Jun;8;98(6):551-5.
9. Matin RN, Mesher D, Proby CM, McGregor JM, Bouwes Bavinck JN, del Marmol V, et al. Melanoma in organ transplant recipients: Clinicopathological features and outcome in 100 cases. Am J Transplant. 2008;8(9):1891-900.
10. Zwald FO, Christenson LJ, Billingsley EM, Zeitouni NC, Ratner D, Bordeaux J, et al. Melanoma in solid organ transplant recipients. Am J Transplant 2010;10(5):1297-304.
E-poster Galderma/egora : Transplantés d’organes solides, prendre en cancer de la peau au sérieux :https://www.egora.fr/greffe_et_cancer_cutane