Le système immunitaire joue un rôle majeur dans la détection et la clairance des cellules tumorales (immunosurveillance antitumorale). Il est donc logique qu’une immunosuppression chronique telle que chez les transplantés d’organes solides augmente le risque de développement de cancers. Ainsi, chez les transplantés d’organes solides, 40 à 50 % des cancers sont des cancers cutanés non mélanocytaires. Le mélanome représente 6 % des cancers survenant chez les transplantés adultes. La prise en charge individuelle de ces cancers et l’instauration de thérapeutiques anticancéreuses comme la chimiothérapie, les thérapies ciblées ou l’immu-nothérapie antitumorale, nécessitent une prise en charge conjointe entre dermatologue, oncologue, chirurgien, radiothérapeute et transplanteurs qui doit être validée lors de concertation pluridisciplinaire.
Traitement du cancer primitif
Chirurgie et radiothérapie
Les carcinomes cutanés
Le traitement du primitif est identique à celui des patients immunocompétents. Il repose principalement sur la chirurgie. La radiothérapie adjuvante peut être proposée en cas d’exérèse incomplète pour les carcinomes épidermoïdes cutanés (CEC), principalement en cas d’envahissement ganglionnaire important ou périneural, comme chez les patients immunocompétents, du fait du risque accru de récurrence. Cependant, il est nécessaire d’élargir les marges pour traiter de possibles disséminations cutanées infracliniques. La réalisation de la technique du ganglion sentinelle peut également être proposée1.
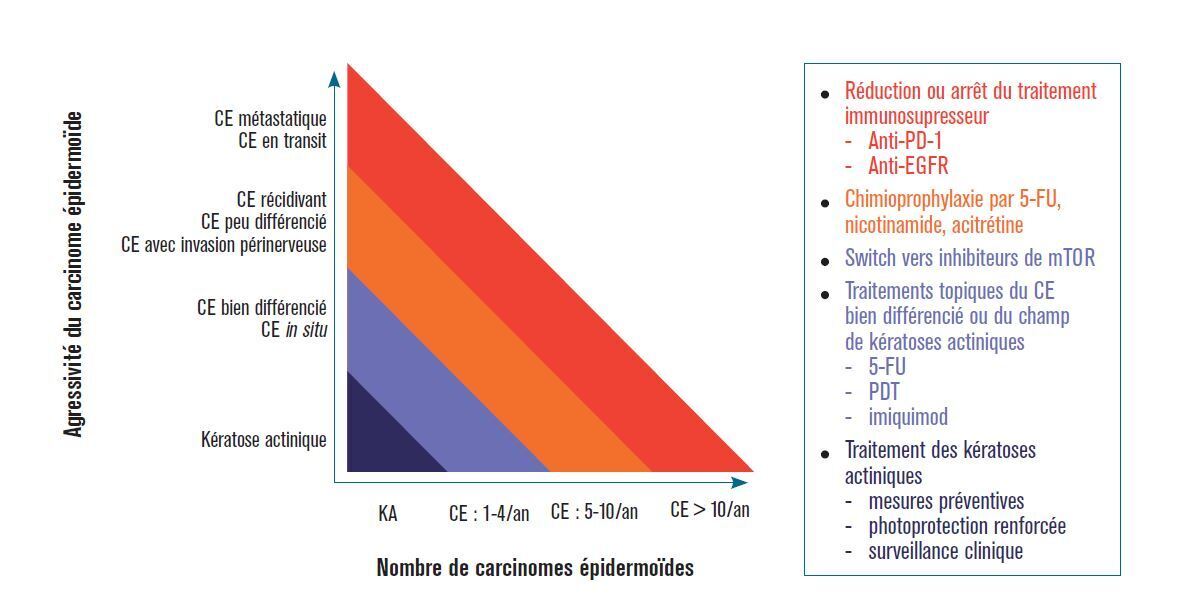
Pour les formes à faible risque de rechute et étendues, l’application de traitements topiques tels que l’imiquimod ou le 5-fluoro-uracile de façon cyclique peut être proposée. La photothérapie dynamique (PDT) peut diminuer l’incidence des carcinomes épidermoïdes chez les transplantés en traitant les lésions aux stades plus précoces2. Il s’agit d’un traitement non invasif qui repose sur l’interaction entre un agent photosensibilisant (la protoporphyrine IX) et une source lumineuse de longueur d’onde adaptée au spectre d’absorption du photosensibilisant1. Après une préparation de la peau par curetage, un précurseur de la protoporphyrine IX est appliqué sous forme de crème. Après trois heures d’incubation, la crème est rincée, et le dermatologue procède à l’illumination des lésions en lumière rouge pour une dose totale de 37 J/cm2. La photoprotection de la zone traitée est recommandée pendant vingt-quatre heures après l’illumination ainsi que l’application d’émollients. Une prise en charge antalgique pendant et après le geste est nécessaire.
L’administration de rétinoïdes systémiques (acitrétine) peut également être proposée chez les patients qui développent 5 à 10 CEC par an1. Enfin, le nicotinamide est aussi proposé (vitamine PP) dans les formes récidivantes de carcinome épidermoïde.
Dans le mélanome
Le traitement classique du primitif ne diffère pas de celui concernant les patients immunocompétents : exérèse suivie d’une reprise avec des marges selon l’indice de Breslow de la tumeur et si besoin réalisation d’une biopsie du ganglion sentinelle.
Le carcinome de Merkel (CCM)
Il a été démontré que, dans ce contexte, les patients traités par chirurgie ou par radiothérapie palliative ou curative présentaient un taux de rechute plus élevé3-5. Il a été suggéré d’envisager une intensification de ce type de radiothérapie chez ces patients4. Cependant, aucune différence en termes d’efficacité n’a été mise en évidence pour la radiothérapie adjuvante6. La radiothérapie adjuvante devrait être envisagée à des doses standard non seulement pour les patients immunocompétents mais aussi pour les patients immunodéprimés atteints de CCM localisé.
Gestion du traitement immunosuppresseur
La modification de l’immunosuppression peut consister en l’interruption du traitement immunosuppresseur, la diminution des taux plasmatiques d’immunosuppresseur ou bien le switch de traitement immunosuppresseur pour un inhibiteur de mTOR. Il est important de trouver un équilibre entre un niveau d’immunosuppression qui ne favorisera pas la propagation de la tumeur et qui n’entraînera pas le rejet de l’organe greffé. Les facteurs importants à prendre en compte sont le type de tumeur, le stade et le pronostic de la tumeur, le type d’organe transplanté et la possibilité de reproduire artificiellement sa fonction (par exemple, la dialyse dans le cas des reins) et l’état de santé général du patient.
Il a été démontré que le passage aux inhibiteurs de mTOR réduisait la survenue de CEC ultérieurs dans le cadre de la prévention secondaire (récidive du cancer)7-9. Nous proposons un schéma de traitement selon l’agressivité du CEC/lésion précancéreuse et le nombre de carcinomes adapté d’après Mittal A et al.10 (figure). Pour les autres cancers cutanés, le rapport risque/bénéfice de la réduction (minimisation) des médicaments immunosuppresseurs doit être considéré et discuté au cas par cas. En effet, dans le CCM, il n’existe actuellement aucune preuve objective de cela. Il n’existe pas non plus de preuve que le switch des immunosuppresseurs empêche la dissémination métastatique du cancer.
Prise en charge des formes avancées
Immunothérapie antitumorale
L’immunosuppression ayant été un critère d’exclusion des essais cliniques pivots, les données concernant l’efficacité et les effets indésirables des immunothérapies chez les patients immunodéprimés atteints de cancers cutanés avancés sont limitées. L’axe PD-1/PD-L1 est particulièrement impliqué dans le maintien de la fonction du greffon chez les transplantés11, 12. L’immunothérapie anti-PD-1 (inhibiteurs des points de contrôle de l’immunité) peut donc intuitivement être responsable du rejet du greffon chez les patients traités en activant la défense immunitaire. Nous ne possédons que peu de données concernant les patients transplantés traités par immunothérapie pour un cancer solide, mais des résultats encourageants en termes de contrôle tumoral ont été rapportés, principalement chez les greffés rénaux. La fonction du greffon a été préservée chez deux tiers des patients, et le décès était le plus souvent lié à la progression du cancer13-15. En cas de rejet, celui-ci semble précoce, survenant principalement dans les six mois suivant l’instauration du traitement et aboutissant à une dysfonction du greffon dans 71 % des cas16. Les facteurs associés à une préservation du greffon semblent être : l’absence d’histoire de rejet du greffon, un délai entre l’introduction de l’immunothérapie et la transplantation supérieur à huit ans, un traitement par immunosuppresseur, en plus des corticoïdes, notamment le switch pour un inhibiteur de mTOR16.
Dans le cadre du CCM, seulement quelques cas ont été rapportés, et aucune donnée provenant de grandes cohortes rétrospectives ou prospectives n’est actuellement disponible. Des études de cohorte sont donc nécessaires afin d’évaluer l’efficacité et la tolérance des immunothérapies dans cette indication17. Dans le mélanome et les CEC, quelques séries rétrospectives ont rapporté des résultats encourageants sur de petites cohortes18-20. Ces données méritent d’être confirmées dans des essais cliniques prospectifs de plus grande envergure16.
Thérapies ciblées
Dans le mélanome, l’association d’un anti-BRAF et d’un anti-MEK est possible pour le mélanome avancé présentant une mutation BRAF. Des réponses acceptables ont été décrites avec ces thérapies chez les patients transplantés21, 22. Des données suggèrent que la mutation BRAF est néanmoins moins fréquente chez les patients transplantés que chez les immunocompétents23, 24, 25.
Le cétuximab (inhibiteur de l’epithelial growth factor receptor [EGFR]) peut être utilisé pour la prise en charge des CEC localement avancés ou métastatiques en association avec la chimiothérapie si l’état général du patient le permet26.
La voie de signalisation Sonic Hedgehog est capitale dans l’oncogenèse des carcinomes basocellulaires (CBC) : des mutations inhibitrices du gène patched-1 sont retrouvées dans 90 % des CBC sporadiques. Dans les 10 % restants de CBC, on trouve des mutations activatrices du gène smo. Pour la prise en charge des CBC localement avancés/métastatiques, deux molécules disposent actuellement d’une autorisation de mise sur le marché (AMM) : le vismodégib27 (AMM 2013) et le sonidégib28 (AMM 2015). Il s’agit de thérapies ciblant la protéine transmembranaire Smoothened (SMO), entraînant son inhibition et bloquant ainsi la voie de signalisation Sonic Hedgehog29,30. Les taux de réponse varient de 45 à 56 % avec ces molécules pour les CBC localement avancés31. Chez les transplantés d’organes, leur efficacité est fondée seulement sur des case reports. Des études de cohorte de plus grande envergure sont également nécessaires pour affirmer l’efficacité de ces traitements dans les CBC chez les transplantés d’organes32.
Chimiothérapie
Concernant le traitement des CEC et des CCM par chimiothérapie, seules des données issues de petites cohortes de patients traités sont disponibles à ce jour. Les taux de réponse sont généralement élevés mais les rechutes rapides33. L’association de la chimio-thérapie à la radiothérapie peut être proposée dans les formes localement avancées inopérables. Ces associations sont souvent préférées aux immunothérapies car elles ne sont pas associées à un risque de rejet du greffon.
Dans le mélanome, la chimiothérapie n’a pas de place dans l’arsenal thérapeutique à visée curative. Elle peut être proposée à visée palliative telle que le témozolomide, la dacarbazine ou la mupirocine.
Cet article fait partie d'un supplément ayant bénéficié du soutien strictement institutionnel de Galderma, sans intervention de leur part dans l’élaboration du sommaire, le choix des auteurs et la rédaction des articles.
1. O’Reilly Zwald F, Brown M. Skin cancer in solid organ transplant recipients: Advances in therapy and management: Part I. Epidemiology of skin cancer in solid organ transplant recipients. J Am Acad Dermatol 2011;65:263-79.
2.Dragieva G, Hafner J, Dummer R, Schmidt-Gendelmeier P, Roos M, Prinz BM, et al. Topical photodynamic therapy in the treatment of actinic keratoses and Bowen’s disease in transplant recipients. Transplantation 2004;77:115-21.
3. Cook M, Baker K, Redman M, Lachance K, Nguyen MH, Parvathaneni U, et al. Differential outcomes among immunosuppressed patients with merkel cell carcinoma. Am J Clin Oncol Cancer Clin Trials 2019;42:82-8.
4. Tseng YD, Nguyen MH, Baker K, Cook M, Redman M, Lachance K et al. Effect of patient immune status on the efficacy of radiation therapy and recurrence-free survival among 805 patients with Merkel cell carcinoma. Int J Radiat Oncol 2018;102:330-9.
5. Iyer JG, Parvathaneni U, Gooley T, Miller NJ, Markowitz E, Blom A, et al. Single‐fraction radiation therapy in patients with metastatic Merkel cell carcinoma. Cancer Med 2015;4:1161-70.
6. Yusuf MB, Gaskins J, Wall W, Tennant P, Bumpous J, Dunlap N. Immune status and the efficacy of radiotherapy on overall survival for patients with localized Merkel cell carcinoma: An analysis of the National Cancer Database. J Med Imaging Radiat Oncol 2020;64:435-43.
7. Euvrard S, Morelon E, Rostaing L, Goffin E, Brocard A, Tromme I, et al. Sirolimus and secondary skin-cancer prevention in kidney transplantation.N Engl J Med 2012;367:329-39.
8. Hoogendijk-van den Akker JM, Harden PN, Hoitsma AJ, Proby CM, Wolterbeek R, Bouwes Bavink JN, et al. Two-year randomized controlled prospective trial converting treatment of stable renal transplant recipients with cutaneous invasive squamous cell carcinoma to sirolimus. J Clin Oncol 2013;31:1317-23.
9. Dantal J, Morelon E, Rostaing L, Goffin E, Brocard A, Tromme I et al. Sirolimus for secondary prevention of skin cancer in kidney transplant recipients: 5-years results. J Clin Oncol 2018;36:2612-20.
10. Mittal A, Colegio OR. Skin cancers in organ transplant recipients. Am J Transplant 2017;17:2509-30.
11. Tanaka K, Albin MJ, Yuan X, Yamaura K, Habicht A, Murayama T, et al. PDL1 is required for peripheral transplantation tolerance and protection from chronic allograft rejection. J Immunol 2007;179:5204-10.
12. Riella LV, Watanabe T, Sage PT, Yang J, Yeung M, Azzi J, et al. Essential role of PDL1 expression on nonhematopoietic donor cells in acquired tolerance to vascularized cardiac allografts. Am J Transplant 2011;11:832-40.
13. Delyon J, Zuber J, Dorent R, Poujol-Robert A, Peraldi MN, Anglicheau D, et al. Immune checkpoint inhibitors in transplantation - A case series and comprehensive review of current knowledge. Transplantation 2021;105:67-78.
14. De Bruyn P, Van Gestel D, Ost P, Kruse V, Brochez L, Van Vlierberghe H, et al. Immune checkpoint blockade for organ transplant patients with advanced cancer: how far can we go? Curr Opin Oncol 2019;31:54-64.
15. Fisher J, Zeitouni N, Fan W, Samie FH. Immune checkpoint inhibitor therapy in solid organ transplant recipients: A patient-centered systematic review. J Am Acad Dermatol 2020;82:1490-500.
16. d’Izarny Gargas T, Durrbach A, Zaidan M. Efficacy and tolerance of immune checkpoint inhibitors in transplant patients with cancer: A systematic review. Am J Transplant 2020;20:2457-65.
17. Singh P, Visger Von J, Prosek J, Rovin B, Pesavento TE, Olencki T, et al. Preserved renal allograft function and successful treatment of metastatic Merkel cell cancer post nivolumab therapy. Transplantation 2019;103:e52-e53.
18. De Bruyn P, Van Gestel D, Ost P, Kruse V, Brochez L, Van Vlierberghe H et al. Immune checkpoint blockade for organ transplant patients with advanced cancer: How far can we go? Curr Opin Oncol 2019;31:54-64.
19. Maggiore U, Pascual J. The bad and the good news on cancer Iimmunotherapy: Implications for organ transplant recipients. Adv Chronic Kidney Dis 2016;23:312-6.
20. Tsung I, Worden FP, Fontana RJ. Safety and efficacy of checkpoint inhibitors in solid organ transplant recipients with cutaneous squamous cell carcinoma. J Clin Oncol 2020;38:e22014-e22014.
21. Garrett GL, He SY, Sabouni N, Daud A, Arron ST. Combined dabrafenib and trametinib therapy in metastatic melanoma and organ transplantation: Case report and review of the literature. JAAD Case Reports 2015;1:S23-S25.
22. Afshar K, David S, Fuehner T, Gottlieb J, Gutzmer R. BRAF Inhibition in a lung transplant recipient with metastatic melanoma. JAMA Dermatology 2016;152:228.
23. Brocard A, Knol AC, Bossard C, Denis MG, Quéreux G, Saint-Jean M, et al. Clinical, genetic and innate immunity characteristics of melanoma in organ transplant recipients. Acta Derm Venereol 2017;97:483-8.
24. Kanitakis J, Baldassini S, Lora V, Euvrard S. BRAF mutations in melanocytic tumors (nevi and melanomas) from organ transplant recipients. Eur J Dermatology 2010;20:167-71.
25. González-Cruz C, Ferrándiz-Pulido C, García-Patos Briones V. Melanoma in solid organ transplant recipients. Actas Dermo-Sifiliográficas (English Ed) 2021;112:216-24.
26. Maubec E, Petrow P, Scheer-Senyarich I, Duvillard P, Lacroix L, Gelly J et al. Phase II study of cetuximab as first-line single-drug therapy in patients with unresectable squamous cell carcinoma of the skin. J Clin Oncol 2011;29: 3419-26.
27. https://www.has-sante.fr/upload/docs/evamed/CT-13179_ERIVEDGE_PIC_INS_Avis2_CT13179.pdf
28. https://www.has-sante.fr/upload/docs/evamed/CT-14814_ODOMZO_PIC_INS_Avis3_CT14814.pdf
29. https://www.vidal.fr/medicaments/substances/vismodegib-23808.html
30. https://www.vidal.fr/medicaments/substances/sonidegib-24567.html#:~:text=Il%20se%20lie%20au%20r%C3%A9cepteur,de%20Hh%20impliqu%C3%A9s%20dans%20la
31. Sekulic A, et al. Pivotal ERIVANCE basal cell carcinoma (BCC) study: 12-month update of efficacy and safety of vismodegib in advanced BCC. J Am Acad Dermatol 2015;72:1021-6.e8.
32. Rahatli S, Oguz A, Altundag O, Haberal M. Vismodegib experience in a renal transplant patient with basal cell carcinoma. Exp Clin Transplant 2020; doi:10.6002/ect.2019.0293
33.Chapalain M, Baroudjian B, Dupont A, Lhote R, Lambert J, Bagot M et al. Stage IV cutaneous squamous cell carcinoma: treatment outcomes in a series of 42 patients. J Eur Acad Dermatology Venereol 2019;doi:10.1111/jdv.16007.