L’indication de la chirurgie du rachis dépend du patient bien sûr, du bilan lésionnel mais aussi de l’expérience du chirurgien. Le dialogue est primordial, tant pour l’analyse de la douleur ressentie que pour le commentaire des examens d’imagerie. Le profil psychologique du patient revêt une grande importance dans la satisfaction ou non du résultat de la chirurgie. Et finalement, le chirurgien décide de l’indication également selon son vécu. Analyse de tous les facteurs en jeu.
Quelle que soit la pathologie rachidienne considérée (traumatique, dégénérative, tumorale ou infectieuse), la chirurgie a deux buts principaux : décomprimer les structures nerveuses (moelle épinière et nerfs rachidiens) pour améliorer un déficit neurologique ou une douleur, et fusionner les vertèbres entre elles en cas d’instabilité créée par un traumatisme, une arthrose agressive, une tumeur ou une infection destructive, voire parfois par un geste opératoire ; décompression et stabilisation sont souvent associées. La chirurgie rachidienne est ainsi essentiellement fonctionnelle, avec pour finalité d’améliorer rachialgie et déficit neurologique.
Avançant dans la longue carrière de chirurgien du rachis, nous nous sommes surpris, lors de consultations, à dire de plus en plus souvent : « Il me semble qu’il ne faut pas vous opérer ! »
Pourquoi ? Est-ce en rapport avec la déception face aux résultats des nombreuses chirurgies pratiquées ? Probablement pas : une chirurgie rachidienne appliquée avec les deux buts expliqués plus haut n’a pas d’alternative thérapeutique.
Est-ce dû au changement progressif de la patientèle ? Les délais de consultation, la sélection des correspondants au fil des ans, les demandes de second avis, le recrutement variable des urgences chirurgicales, les hétérogénéités régionales… modèlent la pratique et l’expérience.
Est-ce aussi en rapport avec une meilleure connaissance de l’évolution très souvent favorable de beaucoup de situations, notamment dans la pathologie arthrosique, ou une meilleure connaissance des alternatives thérapeutiques ? Oui, et nous y reviendrons plus en détail.
Quels sont finalement les facteurs qui ont conduit à une attitude chirurgicale progressivement plus sélective ?
Pour tenter de les reconnaître, nous étudierons successivement les trois acteurs intervenant autour de l’indication opératoire : le patient, le résultat du bilan lésionnel et, bien sûr, le chirurgien.
Avançant dans la longue carrière de chirurgien du rachis, nous nous sommes surpris, lors de consultations, à dire de plus en plus souvent : « Il me semble qu’il ne faut pas vous opérer ! »
Pourquoi ? Est-ce en rapport avec la déception face aux résultats des nombreuses chirurgies pratiquées ? Probablement pas : une chirurgie rachidienne appliquée avec les deux buts expliqués plus haut n’a pas d’alternative thérapeutique.
Est-ce dû au changement progressif de la patientèle ? Les délais de consultation, la sélection des correspondants au fil des ans, les demandes de second avis, le recrutement variable des urgences chirurgicales, les hétérogénéités régionales… modèlent la pratique et l’expérience.
Est-ce aussi en rapport avec une meilleure connaissance de l’évolution très souvent favorable de beaucoup de situations, notamment dans la pathologie arthrosique, ou une meilleure connaissance des alternatives thérapeutiques ? Oui, et nous y reviendrons plus en détail.
Quels sont finalement les facteurs qui ont conduit à une attitude chirurgicale progressivement plus sélective ?
Pour tenter de les reconnaître, nous étudierons successivement les trois acteurs intervenant autour de l’indication opératoire : le patient, le résultat du bilan lésionnel et, bien sûr, le chirurgien.
Patient : la complexité du ressenti douloureux
Les patients dont nous parlons ici sont ceux souffrant de lésions arthrosiques, dite dégénératives, et se plaignant de rachialgies cervicales ou le plus souvent lombaires. Il s’agit de douleur chronique, et le plus souvent de lombalgie chronique, sujet hautement fonctionnel.1
Huit personnes sur dix connaissent un épisode de lombalgie pendant leur vie et 6 à 8 % basculent vers la chronicité.2 Ces chiffres sont ceux de pays industrialisés ; ils sont bien inférieurs dans les pays émergents.
La grande majorité s’accommode de ce handicap en en parlant à peine au médecin traitant ou en montrant au chirurgien, entre deux portes, des radiographies ou une imagerie par résonance magnétique (IRM) dévoilant des images arthrosiques bien marquées pour une gêne consentie (nous reviendrons dans le chapitre suivant sur cette distorsion anatomoclinique).
D’autres, avant ou plutôt que d’arriver dans le bureau du chirurgien, ont la bonne idée de consulter un kinésithérapeute, un médecin rééducateur ou un rhumatologue.3 Tous ces spécialistes, très compétents en la matière, sont parfois court-circuités pour aller voir directement le chirurgien surtout s’il est plus accessible du fait du grand nombre de sa confrérie à proximité (le nombre créant le besoin).4
Lors de la consultation initiale, une première impression, presque instantanée, partagée par de nombreux collègues expérimentés, fait parfois penser « Ce patient n’est pas chirurgical. » Elle ne repose que sur une sensation subjective, mais elle existe.
De façon plus objective, il faut bien analyser la description de la douleur ressentie par le patient, sa personnalité, sa projection positive vis-à-vis de l’éventuel programme opératoire. Il faut aussi l’intégrer dans un modèle bio-psycho-social, savoir qu’il détient des informations médicales plus ou moins valides captées sur les réseaux sociaux (« patient 2.0 »).
Huit personnes sur dix connaissent un épisode de lombalgie pendant leur vie et 6 à 8 % basculent vers la chronicité.2 Ces chiffres sont ceux de pays industrialisés ; ils sont bien inférieurs dans les pays émergents.
La grande majorité s’accommode de ce handicap en en parlant à peine au médecin traitant ou en montrant au chirurgien, entre deux portes, des radiographies ou une imagerie par résonance magnétique (IRM) dévoilant des images arthrosiques bien marquées pour une gêne consentie (nous reviendrons dans le chapitre suivant sur cette distorsion anatomoclinique).
D’autres, avant ou plutôt que d’arriver dans le bureau du chirurgien, ont la bonne idée de consulter un kinésithérapeute, un médecin rééducateur ou un rhumatologue.3 Tous ces spécialistes, très compétents en la matière, sont parfois court-circuités pour aller voir directement le chirurgien surtout s’il est plus accessible du fait du grand nombre de sa confrérie à proximité (le nombre créant le besoin).4
Lors de la consultation initiale, une première impression, presque instantanée, partagée par de nombreux collègues expérimentés, fait parfois penser « Ce patient n’est pas chirurgical. » Elle ne repose que sur une sensation subjective, mais elle existe.
De façon plus objective, il faut bien analyser la description de la douleur ressentie par le patient, sa personnalité, sa projection positive vis-à-vis de l’éventuel programme opératoire. Il faut aussi l’intégrer dans un modèle bio-psycho-social, savoir qu’il détient des informations médicales plus ou moins valides captées sur les réseaux sociaux (« patient 2.0 »).
Description de la douleur ressentie
Dans la lombalgie chronique, il faut être prudent vis-à-vis d’une indication opératoire car les armes chirurgicales se résument au blocage intervertébral (arthrodèse), voire plus rarement à la prothèse discale, chez le patient qui, de plus, se lance dans un discours ininterrompu de plusieurs minutes en réponse à la question « Quel est votre motif de consultation ? » ; c’est ce que Simonnet appelle la « douleur parole ».5
Le patient présente parfois un écrit de plusieurs pages sur son vécu douloureux (« douleur écriture ») ou des diagrammes très détaillés sur lesquels chaque événement journalier interférant avec sa douleur est consigné.
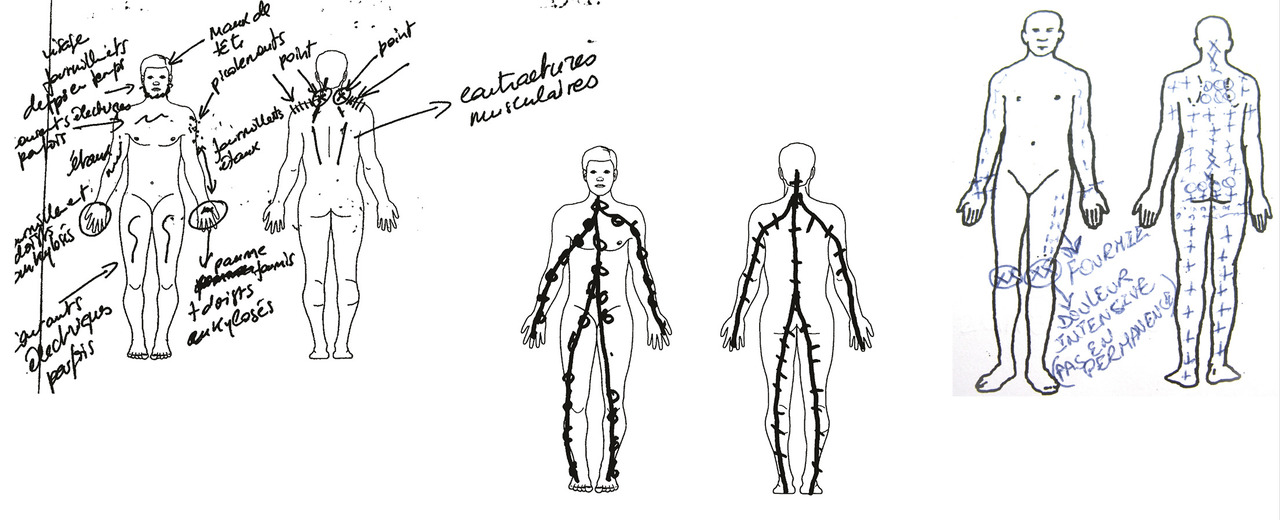
Le dessin de la douleur (outil clinique obligatoire pour toute consultation rachidienne) [fig. 1 ] est souvent caricatural, indiquant, bien sûr, la zone lombaire douloureuse mais avec des points douloureux nombreux et diffus.
Le diagnostic de fibromyalgie est souvent connu du patient. Cette entité nosologique discutée qui s’appelait autrefois « polyenthésopathie » correspond à un état polyalgique chronique qui n’a aucune solution chirurgicale, tout au moins au niveau du rachis. Le terme de « vulnérabilité à la douleur » proposé par Simonnet avec des explications neurophysiologiques, notamment sur l’insuffisance du contrôle inhibiteur diffus nociceptif (CIDN), remplacera peut-être celui de fibromyalgie.5
Il est aussi nécessaire d’être très prudent vis-à-vis d’une indication chirurgicale chez le patient pour lequel toutes les alternatives thérapeutiques ont échoué, le plus surprenant étant d’entendre qu’une infiltration rachidienne d’anti-inflammatoires a aggravé la situation. Le patient ayant vécu tous les moyens conservateurs (médicaments, rééducation, infiltrations) comme un échec pense à tort que la chirurgie est la seule solution à son problème.6
Le patient présente parfois un écrit de plusieurs pages sur son vécu douloureux (« douleur écriture ») ou des diagrammes très détaillés sur lesquels chaque événement journalier interférant avec sa douleur est consigné.
Le dessin de la douleur (outil clinique obligatoire pour toute consultation rachidienne) [
Le diagnostic de fibromyalgie est souvent connu du patient. Cette entité nosologique discutée qui s’appelait autrefois « polyenthésopathie » correspond à un état polyalgique chronique qui n’a aucune solution chirurgicale, tout au moins au niveau du rachis. Le terme de « vulnérabilité à la douleur » proposé par Simonnet avec des explications neurophysiologiques, notamment sur l’insuffisance du contrôle inhibiteur diffus nociceptif (CIDN), remplacera peut-être celui de fibromyalgie.5
Il est aussi nécessaire d’être très prudent vis-à-vis d’une indication chirurgicale chez le patient pour lequel toutes les alternatives thérapeutiques ont échoué, le plus surprenant étant d’entendre qu’une infiltration rachidienne d’anti-inflammatoires a aggravé la situation. Le patient ayant vécu tous les moyens conservateurs (médicaments, rééducation, infiltrations) comme un échec pense à tort que la chirurgie est la seule solution à son problème.6
Personnalité du patient
Sans se servir des questionnaires à caractère purement psychologique comme Havakeshian7, qui a reconnu le « fear avoidance beliefs questionnaire » dans sa partie activité physique (FABG-PA) comme le meilleur outil psychologique pour prévoir le résultat chirurgical, il est possible d’utiliser le questionnaire de Hall8 qui, en cinq questions, permet de comprendre comment le patient se comporte vis-à-vis de sa douleur (tableau ). Ceci permet de déterminer si le patient a un lieu de contrôle interne (avec des systèmes de défense, un coping, une résilience) pouvant faire espérer un bon résultat chirurgical ou, à l’inverse, un lieu de contrôle externe, sans aucune remise en cause personnelle et chez lequel on peut craindre un mauvais résultat chirurgical, avec possibilité de revendication.
Les progrès de l’intelligence artificielle donnent l’espoir d’une meilleure évaluation des patients en intégrant ce type d’information complexe, afin d’optimiser les indications.9
Les progrès de l’intelligence artificielle donnent l’espoir d’une meilleure évaluation des patients en intégrant ce type d’information complexe, afin d’optimiser les indications.9
Projection positive vis-à-vis du résultat de l’acte opératoire
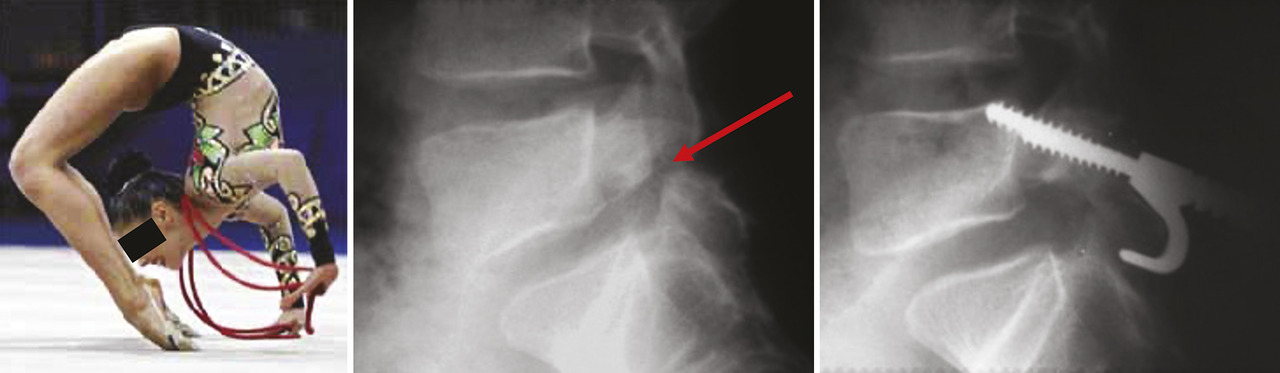
Elle a été parfaitement étudiée par Mannion et al.10 L’exemple caricatural est celui de la reconstruction isthmique du sportif de haut niveau (fig. 2 ) : la chirurgie consiste à greffer et à procéder à une ostéosynthèse de cette fracture de fatigue de l’isthme, le plus souvent de L5 (qui, dans la grande majorité des cas, pourrait devenir indolore grâce au traitement conservateur, qui peut durer plusieurs mois). Le sportif veut cette chirurgie pour reprendre la compétition le plus rapidement possible. Dans toutes les séries, les opérés sont très satisfaits alors que la consolidation osseuse n’est acquise que dans 70 % des cas.11
Le modèle bio-psycho-social
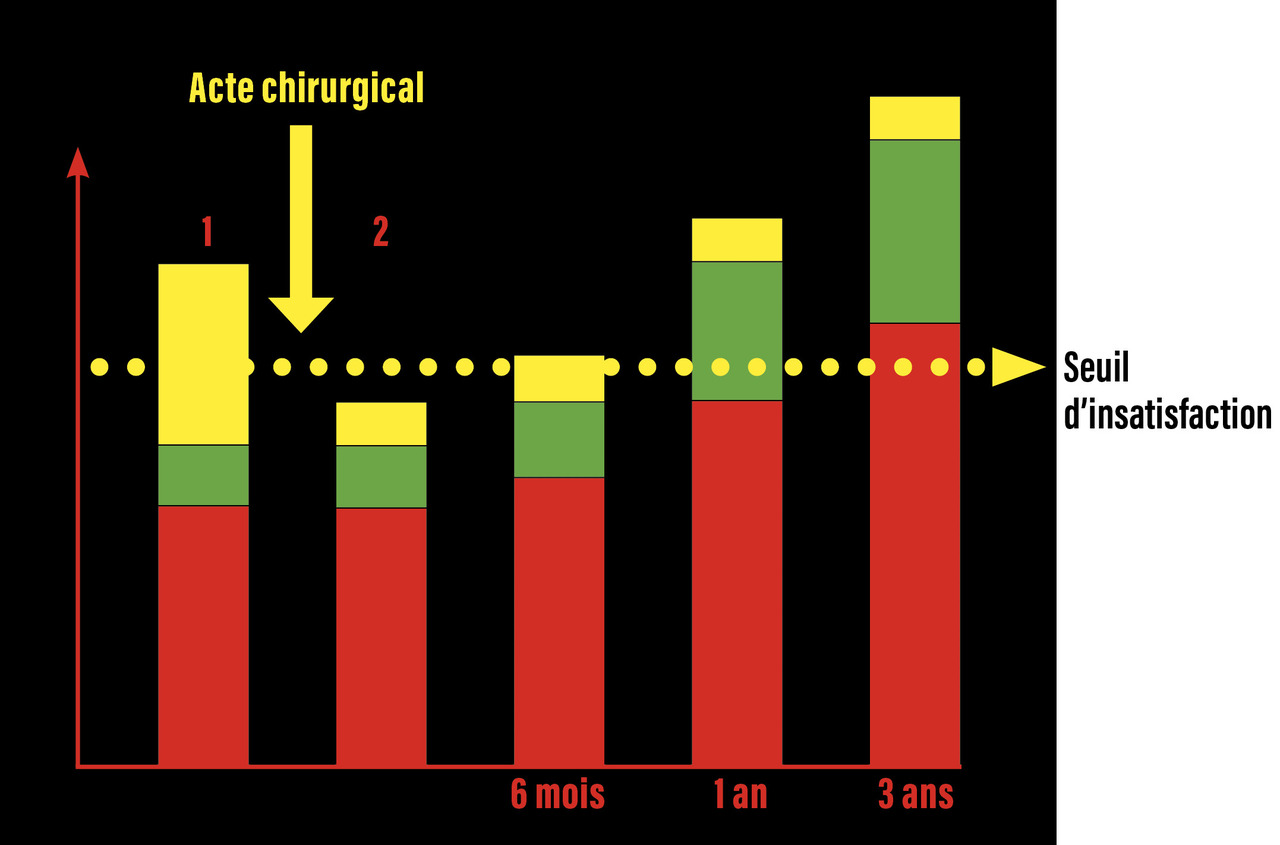
Il est parfaitement représenté par le schéma de Macnab (fig. 3).12 Dans la douleur exprimée par le patient, il y a une part organique (difficile à déterminer dans la lombalgie commune pure, en dehors du signal Modic 1), une part psychologique et une part socioprofessionnelle.
L’acte chirurgical, l’arthrodèse dans le cadre de la lombalgie, réduit partiellement la douleur (facteur organique), mais les facteurs psychosociaux étant toujours présents, le seuil d’insatisfaction initialement disparu en postopératoire risque d’être à nouveau atteint dans le temps et, dans ces circonstances, malgré un acte opératoire parfait, le patient peut être déçu.13
Il existe évidemment des situations dans lesquelles le facteur organique est plus important (par exemple en cas de compression radiculaire ou a fortiori médullaire) ; les indications opératoires sont alors peu discutables et les bons résultats mieux garantis. Seul petit bémol à ce sujet, la compression radiculaire sévère par hernie discale ou arthrose chez le sujet âgé : un tableau brutal avec déficit moteur et peu ou pas de douleur correspond à une ischémie radiculaire, et la levée chirurgicale de la compression, pourtant bien concordante, n’est pas indiquée car pratiquement toujours inefficace sur la parésie.14
L’acte chirurgical, l’arthrodèse dans le cadre de la lombalgie, réduit partiellement la douleur (facteur organique), mais les facteurs psychosociaux étant toujours présents, le seuil d’insatisfaction initialement disparu en postopératoire risque d’être à nouveau atteint dans le temps et, dans ces circonstances, malgré un acte opératoire parfait, le patient peut être déçu.13
Il existe évidemment des situations dans lesquelles le facteur organique est plus important (par exemple en cas de compression radiculaire ou a fortiori médullaire) ; les indications opératoires sont alors peu discutables et les bons résultats mieux garantis. Seul petit bémol à ce sujet, la compression radiculaire sévère par hernie discale ou arthrose chez le sujet âgé : un tableau brutal avec déficit moteur et peu ou pas de douleur correspond à une ischémie radiculaire, et la levée chirurgicale de la compression, pourtant bien concordante, n’est pas indiquée car pratiquement toujours inefficace sur la parésie.14
Mutations sociétales et « patient 2.0 »
Dans tous les domaines, la société change, et cela n’épargne pas la médecine.15 L’immémoriale relation médecin-malade évolue, dans un contexte de nouvelle démographie médicale.16
Les patients, à juste titre, se sont appropriés leur histoire et prennent part aux choix décisionnels les concernant, informés non seulement de façon verticale par le praticien mais également par une constellation de données pas toujours pertinentes issue des réseaux sociaux, des sites généralistes et des avis de proches.17 C’est pourtant une évolution sociétale irréversible, et il nous appartient de garder le cap dans cette profusion d’informations, de faire le tri pour les patients, et de revenir aux éléments fondamentaux de la corrélation anatomoclinique, dans un effort de transparence qui n’est pas encore parfaitement intégré au sein d’une profession en mutation.18
Les patients, à juste titre, se sont appropriés leur histoire et prennent part aux choix décisionnels les concernant, informés non seulement de façon verticale par le praticien mais également par une constellation de données pas toujours pertinentes issue des réseaux sociaux, des sites généralistes et des avis de proches.17 C’est pourtant une évolution sociétale irréversible, et il nous appartient de garder le cap dans cette profusion d’informations, de faire le tri pour les patients, et de revenir aux éléments fondamentaux de la corrélation anatomoclinique, dans un effort de transparence qui n’est pas encore parfaitement intégré au sein d’une profession en mutation.18
Explorations complémentaires du rachis : rechercher la lésion organique
Le patient, comme le médecin, cherche toujours par l’image une explication à la douleur rachidienne ou au déficit neurologique : le patient veut savoir ce qui lui fait mal, le chirurgien s’il y a une bonne corrélation radio-clinique, et donc sur quoi il peut agir en décomprimant, stabilisant, ou les deux.
Trois très puissantes explorations modernes utilisées dans la pathologie dégénérative rachidienne sont évoquées, pour en rappeler les limites et les impacts sur le patient sans contextualisation.
Trois très puissantes explorations modernes utilisées dans la pathologie dégénérative rachidienne sont évoquées, pour en rappeler les limites et les impacts sur le patient sans contextualisation.
Scintigraphie-scanner
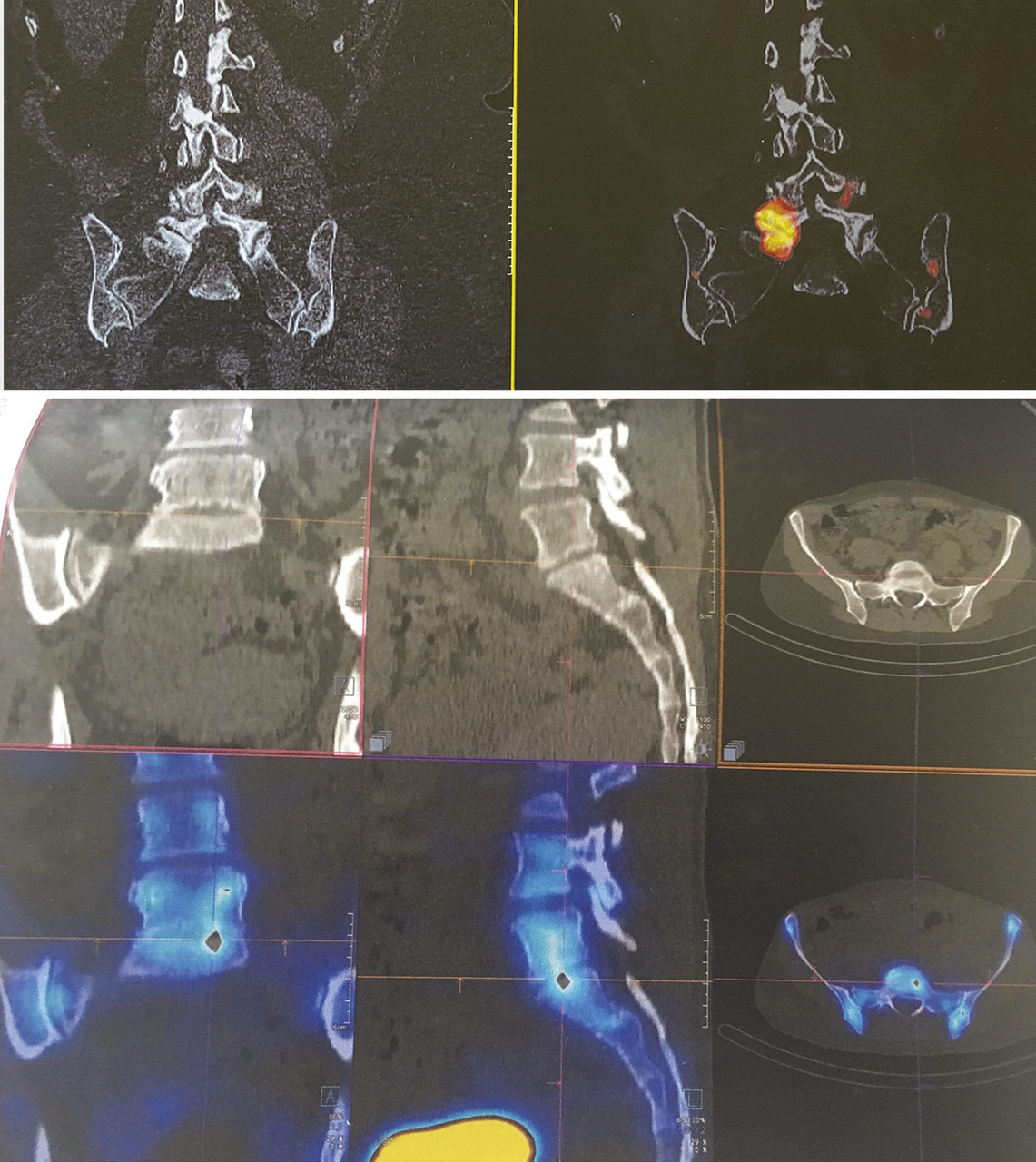
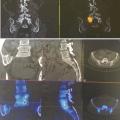
La scintigraphie-scanner a une excellente sensibilité mais une faible spécificité. Le choix de mettre une couleur orange-rouge « flamboyante » sur les zones suspectes est très inquiétant pour le patient qui, en voyant les images, a l’impression de « brûler de l’intérieur » (fig. 4 ). Seule une explication du radiologue permet de relativiser l’impact de l’image et de diminuer le stress du patient.
Imagerie par résonance magnétique (IRM)
L’IRM est un examen incontournable pour prendre une décision chirurgicale en pathologie dégénérative (mais aussi infectieuse ou tumorale) ; seule la traumatologie peut être correctement évaluée par le scanner sans nécessité d’utiliser l’IRM.
Elle permet d’étudier au mieux le contenant ostéoarticulaire et le contenu radiculo-médullaire si le patient est en position allongée.
Il s’agit d’une exploration très sensible, qui ne laisse rien passer et qui est accompagnée d’un compte-rendu très complet dans lequel le radiologue décrit chaque étage intervertébral : protrusion discale physiologique, images qualifiées de « dégénératives » (mot inquiétant pour le patient) qui ne sont qu’arthrosiques, hernies étagées ne correspondant à aucune compression neurologique concordante. Ce ne sont que des images, mais elles sont nombreuses et correspondent très souvent au simple vieillissement de la colonne vertébrale avec déshydratation discale (disque noir), pincement discal, hypertrophie articulaire et ligamentaire conduisant au canal rachidien étroit qui est inexorablement présent à un certain âge mais pas forcément symptomatique ; ces lésions sont comme les « rides au visage ».19
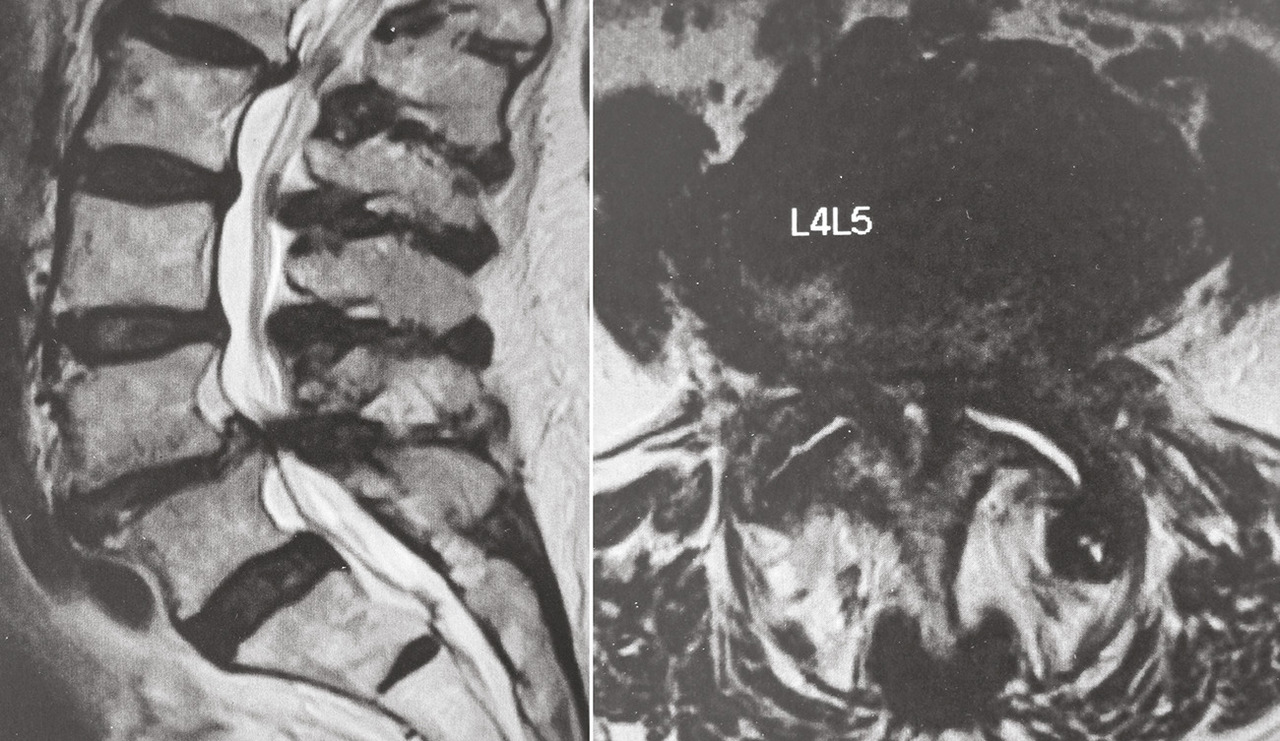
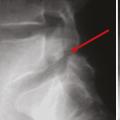
La consultation se résume alors à un avis rassurant, en l’absence de douleur rachidienne ou de signe neurologique concordant avec une hernie discale surprenante par son volume, un canal lombaire très serré (fig. 5 ), un spondylolisthésis par lyse isthmique avec glissement important. L’IRM a néanmoins permis de faire de nets progrès dans la reconnaissance de la discopathie dégénérative inflammatoire (type 1 décrit par Modic)20 corrélée à une gêne fonctionnelle importante ; l’évolution peut se faire vers la cicatrisation spontanée (type 2 graisseux de Modic), mais, le délai pouvant être long, une infiltration discale, voire une chirurgie avec arthrodèse ou prothèse, peut être proposée au patient.21
Elle permet d’étudier au mieux le contenant ostéoarticulaire et le contenu radiculo-médullaire si le patient est en position allongée.
Il s’agit d’une exploration très sensible, qui ne laisse rien passer et qui est accompagnée d’un compte-rendu très complet dans lequel le radiologue décrit chaque étage intervertébral : protrusion discale physiologique, images qualifiées de « dégénératives » (mot inquiétant pour le patient) qui ne sont qu’arthrosiques, hernies étagées ne correspondant à aucune compression neurologique concordante. Ce ne sont que des images, mais elles sont nombreuses et correspondent très souvent au simple vieillissement de la colonne vertébrale avec déshydratation discale (disque noir), pincement discal, hypertrophie articulaire et ligamentaire conduisant au canal rachidien étroit qui est inexorablement présent à un certain âge mais pas forcément symptomatique ; ces lésions sont comme les « rides au visage ».19
La consultation se résume alors à un avis rassurant, en l’absence de douleur rachidienne ou de signe neurologique concordant avec une hernie discale surprenante par son volume, un canal lombaire très serré (
Système EOS
Imaginé par Georges Charpak, validé par l’équipe de radiologie de l’hôpital Saint-Vincent-de-Paul et par Jean Dubousset,22 ce système radiologique est utilisé en clinique depuis l’an 2000. Il s’agit d’une chambre à fils, utilisant des détecteurs gazeux et permettant d’explorer l’ensemble du squelette osseux, de la tête aux pieds, debout en charge, de face et de profil, en 2D mais aussi en 3D. L’irradiation est 8 à 10 fois plus faible que par un système radiographique classique. Cet examen est incontournable dans l’évaluation de l’ensemble des lésions rachidiennes. Il a permis notamment de bien comprendre les phénomènes de décompensation de ce qu’on appelle l’équilibre ou, mieux, l’alignement sagittal. De très nombreux angles ont été décrits, des publications ont foisonné dans le monde entier avec la sensation pour le thérapeute, chirurgien ou non, de donner une valeur vraiment scientifique à son analyse de la douleur ressentie par le patient.23 Deux écueils sont progressivement apparus : les échecs d’une arthrodèse qui n’aurait pas dû être proposée ont été rapportés à un léger défaut d’angle de lordose dans un disque ou entre des vertèbres, lombaires principalement ; les valeurs de référence étaient initialement celles de séries de sujets jeunes, avec des paramètres sagittaux bien différents de ceux de patients plus âgés, devenant de ce fait potentiellement chirurgicaux.24 Le système EOS est une exploration qui a permis de beaucoup progresser dans la connaissance des pathologies rachidiennes, mais, comme toujours, il est impératif de ne pas rester esclave des images, aussi performantes soient-elles.25
Imagerie : un terrain de dialogue entre patient et chirurgien
Les explorations complémentaires du rachis, toutes très performantes, permettent le dialogue entre le patient, qui veut une explication tangible à la cause de sa douleur ou de sa gêne, et le chirurgien, qui veut savoir sur quelle image compressive ou prouvant une instabilité il pourrait éventuellement agir.26 Le chirurgien doit bien expliquer ce qu’il voit, le plus souvent sur l’écran de l’ordinateur. Si le patient amène une IRM concluant à une hernie dans le but qu’elle soit enlevée, alors que sa sciatique s’améliore, il faut lui expliquer qu’il s’agit d’une simple protrusion qui va se résorber et lui montrer l’infiltration graisseuse des muscles paravertébraux incitant plutôt à lui proposer un renforcement musculaire par kinésithérapie.27
Lire aussi | Vaut-il mieux être opéré par une femme ?
Le chirurgien pose l’indication selon son vécu
Neurochirurgien ou orthopédiste ?
Si l’on peut espérer que la chirurgie de la colonne vertébrale devienne un jour une spécialité à part entière – comme la chirurgie de la main –, actuellement le chirurgien du rachis est soit neurochirurgien, soit chirurgien orthopédiste.
La formation est interdisciplinaire, mais le neurochirurgien est plus à l’aise pour opérer dans le canal vertébral, voire dans l’espace intradural, alors que l’orthopédiste a plus de facilité à corriger des déplacements intervertébraux et à les stabiliser. En France, dès 2010, les deux spécialités se sont rapprochées au sein de la Société française de chirurgie rachidienne (SFCR) dont le fonctionnement paritaire est garant de l’homogénéisation des pratiques et de la qualité d’une formation commune.28
La formation est interdisciplinaire, mais le neurochirurgien est plus à l’aise pour opérer dans le canal vertébral, voire dans l’espace intradural, alors que l’orthopédiste a plus de facilité à corriger des déplacements intervertébraux et à les stabiliser. En France, dès 2010, les deux spécialités se sont rapprochées au sein de la Société française de chirurgie rachidienne (SFCR) dont le fonctionnement paritaire est garant de l’homogénéisation des pratiques et de la qualité d’une formation commune.28
Âge et expérience
Il s’agit d’un facteur déterminant dans l’indication opératoire. Merle d’Aubigné, grand patron d’orthopédie de l’après-Deuxième Guerre mondiale, disait : « Il faut cinq ans pour apprendre à opérer, encore cinq ans pour savoir bien opérer et toute une vie pour apprendre quand il ne faut pas opérer. »29
Le jeune chirurgien a hâte de prouver qu’il sait aussi bien opérer que ses aînés et peut craindre que réfuter une indication ne réduise sa future patientèle.
À l’inverse, le chirurgien plus expérimenté a déjà rencontré des complications neurologiques ou vasculaires (pour les voies antérieures), des associations de coxarthrose et de lombarthrose entraînant une cruralgie traitée par une prothèse de hanche ou des résultats fonctionnels incomplets malgré une technique irréprochable, qui pondèrent son enthousiasme initial.
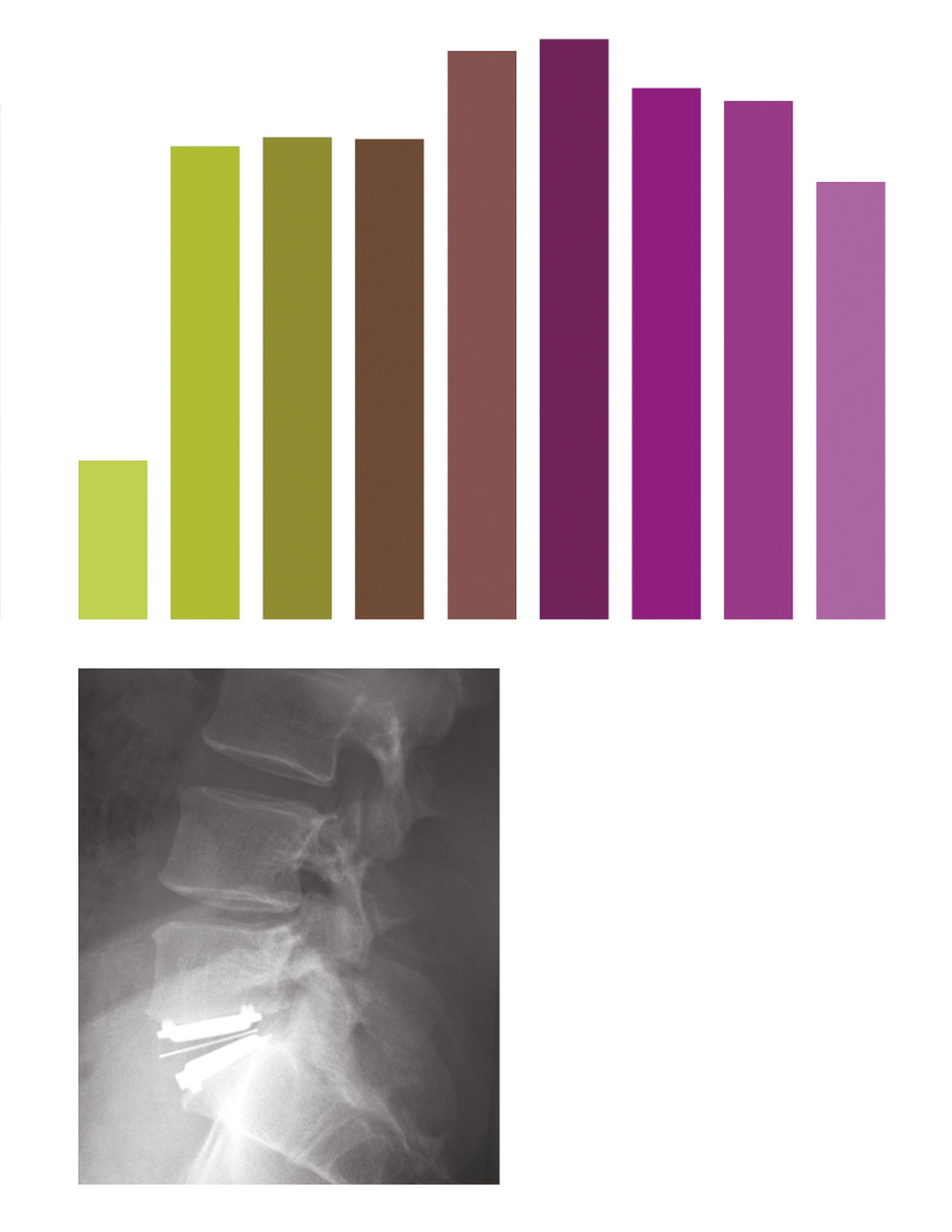
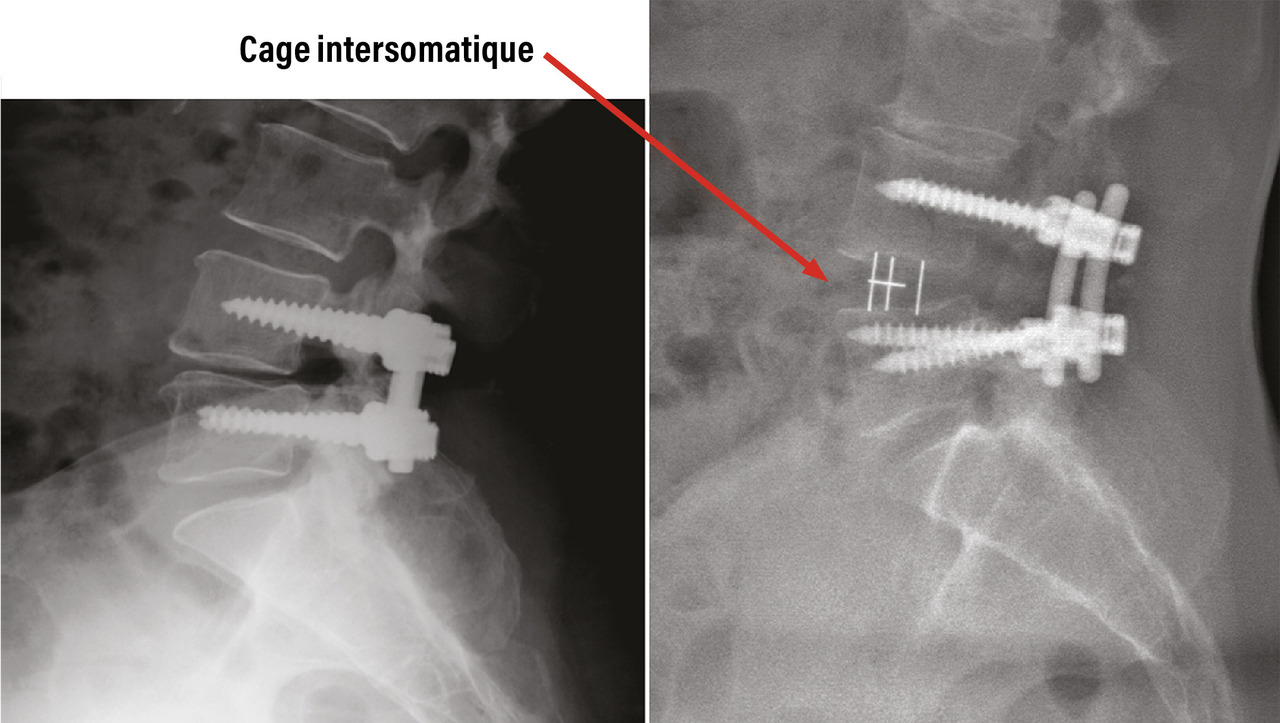
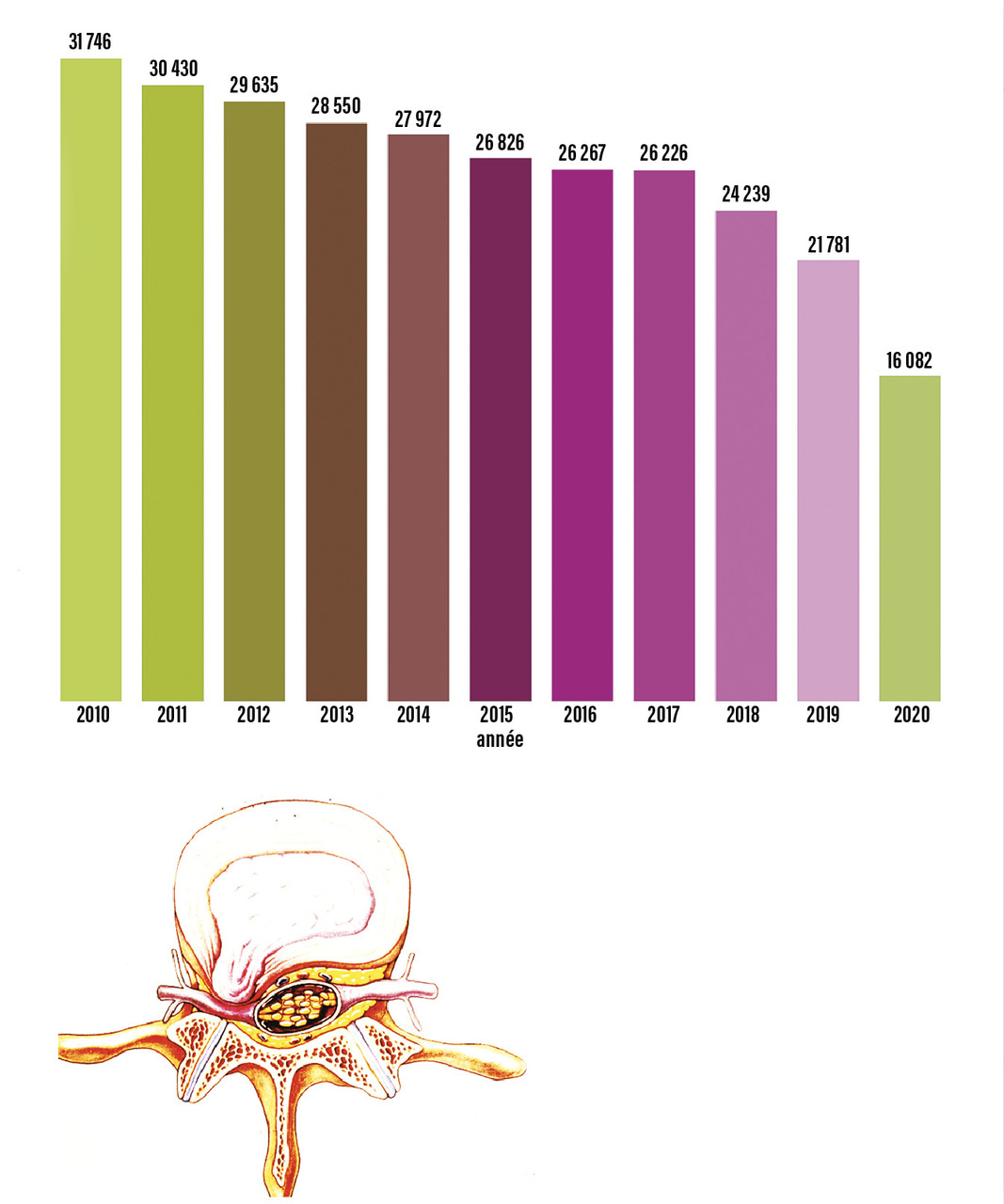
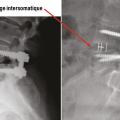
De plus, le jeune chirurgien du rachis est amené à interagir avec les sociétés de matériel chirurgical, qui participent, certes à la formation continue des praticiens et aux progrès de la prise en charge des patients, mais imposent aussi un tempo inflationniste en matière de pose d’implants, entremêlant intérêts médicaux et financiers. Le débat n’est pas nouveau, et les conflits d’intérêts sont fréquents.30 Les prothèses discales ont ainsi eu un net succès en France il y a cinq ans, puis leurs poses ont diminué en fréquence, d’après le recueil de la base PMSI (programme de médicalisation des systèmes d’information) nationale (fig. 6 ).31 L’effet « mode » est facilité par le nombre de cours pratiques organisés par ces sociétés, souvent pour pallier leur absence dans les universités. Beaucoup de jeunes chirurgiens pensent ainsi qu’il est impossible de faire une arthrodèse lombaire sans poser des cages discales, alors qu’un vissage simple est le plus souvent suffisant (fig. 7 ).32 On pourrait espérer que la publication de grandes séries dans la littérature rattrape ce biais d’indications ; il n’en est rien, car peu de séries sont neutres et sans conflit d’intérêts.33
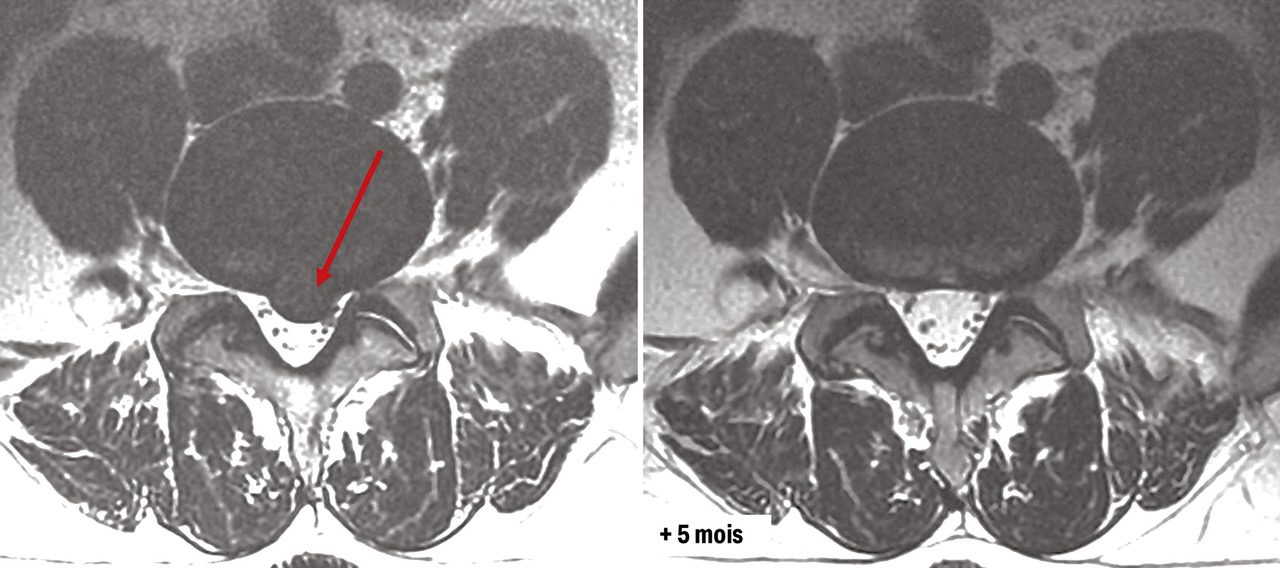
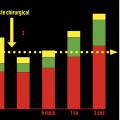
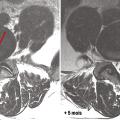
Par ailleurs, le chirurgien senior, avec les années d’expérience, comprend mieux l’évolution favorable, ou la stabilité prolongée de nombreuses pathologies rachidiennes : par exemple, une hernie discale molle peut se résorber spontanément (fig. 8 ) ;34 le nombre de discectomies lombaires chirurgicales diminue ainsi au fil du temps, selon le recueil de la base PMSI en France (fig. 9 ),31 en écho avec un corpus scientifique récent concernant les indications opératoires.35,36 Il faut aussi connaître les alternatives thérapeutiques antalgiques : approches médicamenteuses, infiltrations (épidurales, articulaires postérieures, discales), rééducation (notamment en centre de réadaptation fonctionnelle du rachis ou dans les écoles du dos pour les lombalgies chroniques). Dans un autre ordre d’idée, l’amaigrissement peut être proposé en cas de lipomatose lombaire où la graisse épidurale hypertrophiée comprime les racines de la queue de cheval. Enfin, les bisphosphonates ont stabilisé des tumeurs primitives du rachis comme les tumeurs à cellules géantes, et permis d’éviter des chirurgies d’exérèse lourde et non exemptes de récidive.37
Le jeune chirurgien a hâte de prouver qu’il sait aussi bien opérer que ses aînés et peut craindre que réfuter une indication ne réduise sa future patientèle.
À l’inverse, le chirurgien plus expérimenté a déjà rencontré des complications neurologiques ou vasculaires (pour les voies antérieures), des associations de coxarthrose et de lombarthrose entraînant une cruralgie traitée par une prothèse de hanche ou des résultats fonctionnels incomplets malgré une technique irréprochable, qui pondèrent son enthousiasme initial.
De plus, le jeune chirurgien du rachis est amené à interagir avec les sociétés de matériel chirurgical, qui participent, certes à la formation continue des praticiens et aux progrès de la prise en charge des patients, mais imposent aussi un tempo inflationniste en matière de pose d’implants, entremêlant intérêts médicaux et financiers. Le débat n’est pas nouveau, et les conflits d’intérêts sont fréquents.30 Les prothèses discales ont ainsi eu un net succès en France il y a cinq ans, puis leurs poses ont diminué en fréquence, d’après le recueil de la base PMSI (programme de médicalisation des systèmes d’information) nationale (
Par ailleurs, le chirurgien senior, avec les années d’expérience, comprend mieux l’évolution favorable, ou la stabilité prolongée de nombreuses pathologies rachidiennes : par exemple, une hernie discale molle peut se résorber spontanément (
Autres spécialistes du rachis
Toutes ces connaissances amènent de très nombreux spécialistes qui s’occupent du rachis douloureux dégénératif (médecin rééducateur, rhumatologue, radiologue interventionnel, kinésithérapeute, ostéopathe) à créer un réseau afin de trouver la solution la moins agressive possible pour le patient. Le chirurgien, au cœur de ce maillage, devient en quelque sorte un expert du rachis,38 qui n’a pas que la solution opératoire à proposer. Il faut néanmoins pondérer ce schéma idéal, car il reste souvent difficile à mettre en application, du fait de la démographie médicale, de la disponibilité des examens complémentaires, de la rareté des places en centre de réadaptation fonctionnelle du rachis mais également de la variabilité des attitudes, souvent très antagonistes, des différents spécialistes concernant la prise en charge des pathologies rachidiennes.39
Deuxième avis chirurgical
Un deuxième avis chez un patient déjà opéré par un autre chirurgien doit être envisagé avec prudence, surtout si le résultat de la première procédure est insuffisant selon le patient.40 La proposition d’une reprise chirurgicale doit être scrupuleusement pesée : l’indication de la première chirurgie peut être discutable, le taux de complication plus élevé et, en cas de procédure judiciaire, c’est souvent le dernier chirurgien qui est reconnu responsable du mauvais résultat final.41
Grandeur et misère de l’« evidence-based medicine »
Le chirurgien du rachis doit garder à l’esprit le faible niveau de preuve dans l’immense majorité des pathologies qu’il est amené à gérer.42 Cela doit intervenir dans les informations qu’il délivre et dans le choix thérapeutique qu’il propose à ses patients.
Si des publications récentes de haut niveau ont permis de rationaliser certaines indications chirurgicales (en plaidant généralement pour une diminution de l’invasivité dans la chirurgie des sténoses lombaires, par exemple43), de nombreux défis demeurent : les études prospectives randomisées sont rares, et concernent souvent des éléments techniques plus que des indications.44 Les guidelines sont pauvres et assez souvent peu suivies.45 Cela peut expliquer la variabilité importante des pratiques en chirurgie de la colonne vertébrale46, qui constitue une problématique majeure à expliquer aux patients mais aussi un défi sociétal alors que l’aphorisme hippocratique « Primum non nocere » s’impose d’autant plus à nos décisions que nous traitons des situations fonctionnelles.47
Si des publications récentes de haut niveau ont permis de rationaliser certaines indications chirurgicales (en plaidant généralement pour une diminution de l’invasivité dans la chirurgie des sténoses lombaires, par exemple43), de nombreux défis demeurent : les études prospectives randomisées sont rares, et concernent souvent des éléments techniques plus que des indications.44 Les guidelines sont pauvres et assez souvent peu suivies.45 Cela peut expliquer la variabilité importante des pratiques en chirurgie de la colonne vertébrale46, qui constitue une problématique majeure à expliquer aux patients mais aussi un défi sociétal alors que l’aphorisme hippocratique « Primum non nocere » s’impose d’autant plus à nos décisions que nous traitons des situations fonctionnelles.47
Risques de la médecine défensive
Il arrive également que des praticiens soient méfiants, voire renoncent, à des interventions chirurgicales « à risque » soit en première intention, soit sur des patients déjà opérés, lorsque la personnalité du patient, la pression de l’entourage, les antécédents et comorbidités allégués ou tout simplement la prise de risque technique peuvent les exposer à un risque médico-légal.48
Les modifications sociétales incluent également une judiciarisation de la médecine.49 Il est alors de notre responsabilité de rester vigilant à cette modification de la relation médecin-malade pour éviter au maximum les dérives de la médecine défensive, parfaitement décrites outre-Atlantique :50 les praticiens, exposés à des plaintes majeures et à des conséquences financières et d’exercice dévastatrices, dégradent leurs indications, voire contre-indiquent des interventions, non pas pour le bien du malade mais pour éviter leur propre prise de risque. La situation n’en est pas là en France, peut-être grâce à l’action de l’organisme de gestion des risques en orthopédie Orthorisq.51 Néanmoins, la montée d’une certaine méfiance parmi les chirurgiens du rachis, incluant des traits défensifs, a déjà été rapportée, du fait de la sinistralité importante de cette discipline.52
Les modifications sociétales incluent également une judiciarisation de la médecine.49 Il est alors de notre responsabilité de rester vigilant à cette modification de la relation médecin-malade pour éviter au maximum les dérives de la médecine défensive, parfaitement décrites outre-Atlantique :50 les praticiens, exposés à des plaintes majeures et à des conséquences financières et d’exercice dévastatrices, dégradent leurs indications, voire contre-indiquent des interventions, non pas pour le bien du malade mais pour éviter leur propre prise de risque. La situation n’en est pas là en France, peut-être grâce à l’action de l’organisme de gestion des risques en orthopédie Orthorisq.51 Néanmoins, la montée d’une certaine méfiance parmi les chirurgiens du rachis, incluant des traits défensifs, a déjà été rapportée, du fait de la sinistralité importante de cette discipline.52
La phrase magique
Dans toute consultation, et ce d’autant qu’on comprend qu’il n’y a pas d’indication chirurgicale, la phrase magique qui permet au patient de tout entendre parce qu’il se sent compris par le chirurgien est « Je comprends que vous êtes en grande souffrance. » À laquelle on ajoute « Néanmoins, la chirurgie n’est pas indiquée chez vous. » Un discours positif est ensuite déroulé, insistant sur les autres possibilités thérapeutiques, sur les chances d’évolution spontanée favorable (exemple du phénomène de restabilisation décrit dans la pathologie dégénérative :53 les segments intervertébraux [disques et articulaires postérieures] finissant par ne plus bouger et ne sont plus douloureux).
À la question « Mais que vais-je devenir ? », répondre : « Les choses peuvent s’améliorer avec le temps, et on va vous aider avec des thérapeutiques conservatrices. »
Il faut, par un discours bienveillant, arriver à recaler les espoirs parfois démesurés du patient avec la réputation parfois excessive du chirurgien, qui n’est pas un magicien mais un conseiller éclairé.54
À la question « Mais que vais-je devenir ? », répondre : « Les choses peuvent s’améliorer avec le temps, et on va vous aider avec des thérapeutiques conservatrices. »
Il faut, par un discours bienveillant, arriver à recaler les espoirs parfois démesurés du patient avec la réputation parfois excessive du chirurgien, qui n’est pas un magicien mais un conseiller éclairé.54
Lire aussi | Chirurgie ambulatoire : bientôt en France ?
Huit leçons tirées de l’expérience
• La chirurgie rachidienne dans la pathologie arthrosique (ou dégénérative) doit être le dernier recours, en dehors des compressions radiculo-médullaires. Elle est très efficace dans cette dernière circonstance mais « agressive » et aux effets irréversibles.
• L’évolution des rachialgies communes ou arthrosiques est le plus souvent spontanément favorable ; il faut bien connaître les alternatives thérapeutiques non chirurgicales et travailler en réseau multidisciplinaire.
• Les explorations radiologiques rachidiennes modernes et puissantes, dominées par l’IRM et le système EOS, montrent des images qui sont souvent en rapport avec le simple vieillissement physiologique.
• Les comptes-rendus de ces examens peuvent sembler alarmistes et doivent être expliqués aux patients.
• Aucune technique opératoire, même parfaite, ne peut rattraper une mauvaise indication, portée le plus souvent en l’absence de corrélation anatomoclinique et en ne tenant pas compte de la personnalité du patient.
• Les techniques mini-invasives ne doivent pas faire élargir les indications opératoires ; elles doivent uniquement permettre d’améliorer les suites opératoires précoces (et peut-être à distance).
• Il faut prendre du recul par rapport aux sociétés de matériel chirurgical qui peuvent, certes aider à la formation, mais ont tendance à promouvoir la surconsommation.
• Finalement, l’idéal pour le chirurgien du rachis serait de devenir un expert en pathologie rachidienne, au centre d’une filière multidisciplinaire, et n’utilisant la chirurgie que lorsqu’elle est nécessaire.
• L’évolution des rachialgies communes ou arthrosiques est le plus souvent spontanément favorable ; il faut bien connaître les alternatives thérapeutiques non chirurgicales et travailler en réseau multidisciplinaire.
• Les explorations radiologiques rachidiennes modernes et puissantes, dominées par l’IRM et le système EOS, montrent des images qui sont souvent en rapport avec le simple vieillissement physiologique.
• Les comptes-rendus de ces examens peuvent sembler alarmistes et doivent être expliqués aux patients.
• Aucune technique opératoire, même parfaite, ne peut rattraper une mauvaise indication, portée le plus souvent en l’absence de corrélation anatomoclinique et en ne tenant pas compte de la personnalité du patient.
• Les techniques mini-invasives ne doivent pas faire élargir les indications opératoires ; elles doivent uniquement permettre d’améliorer les suites opératoires précoces (et peut-être à distance).
• Il faut prendre du recul par rapport aux sociétés de matériel chirurgical qui peuvent, certes aider à la formation, mais ont tendance à promouvoir la surconsommation.
• Finalement, l’idéal pour le chirurgien du rachis serait de devenir un expert en pathologie rachidienne, au centre d’une filière multidisciplinaire, et n’utilisant la chirurgie que lorsqu’elle est nécessaire.
Références
1. Deyo RA. Fusion surgery for lumbar degenerative disc disease: Still more questions than answers. Spine J 2015;15:272-4.
2. Deyo RA, Mirza SK, Martin BI. Back pain prevalence and visit rates: Estimates from U.S. national surveys, 2002. Spine 2006;31:2724-7.
3. Arana E, Kovacs FM. The evidence gap in low back pain management strategies. Lancet 2021;398:1130-1.
4. Wilgenbusch CS, Wu AS, Fourney DR. Triage of spine surgery referrals through a multidisciplinary care pat hway: A value-based comparison with conventional referral processes. Spine 2014;39:S129-135.
5. Simonnet G, Laurent B, Le Breton D. L’homme douloureux. Éditions Odile Jacob, Paris 2019.
6. Vital JM, Boudissa M, Campana M. Surgery for chronic low back pain: Good option? Better than conservative treatment? Bull Acad Natl Med 2015;199:1367-82.
7. Havakeshian S, Mannion AF. Negative beliefs and psychological disturbance in spine surgery patients: A cause or consequence of a poor treatment outcome? Eur Spine J 2013;22:2827-35.
8. Hall H. Effective spine triage: Patterns of pain. Ochsner J 2014;14: 88-95.
9. Khor S, Lavallee D, Cizik AM, Bellabarba C, Chapman JR, Howe CR, et al. Development and validation of a prediction model for pain and functional outcomes after lumbar spine surgery. JAMA Surgery 2018;153: 634-42.
10. Mannion AF, Junge A, Elfering A, Dvorak J, Porchet F, Grob D. Great expectations: Really the novel predictor of outcome after spinal surgery? Spine (Phila Pa 1976) 2009;34: 1590-9.
11. Linton AA, Hsu WK. A review of treatment for acute and chronic pars fractures in the lumbar spine. Curr Rev Musculoskelet Med 2022;15:259-71.
12. Macnab I. Negative disc exploration. An analysis of the causes of nerve-root involvement in sixty-eight patients. J Bone Joint Surg Am 1971;53:891-903.
13. Porchet F, Lattig F, Grob D, Kleinstueck FS, Jeszenszky D, Paus C, et al. Comparison of patient and surgeon ratings of outcome 12 months after spine surgery: Presented at the 2009 Joint Spine Section Meeting. J Neurosurg Spine 2010;12: 447-55.
14. Aljawadi A, Sethi G, Islam A, Elmajee M, Pillai A. Sciatica presentations and predictors of poor outcomes following surgical decompression of herniated lumbar discs: A review article. Cureus. 12: e11605.
15. Truog RD. Patients and doctors - The evolution of a relationship. N Engl J Med 2012;366: 581-5.
16. Matthies N, Keshen S, Lewis S, Webster F, Perruccio AV, Rampersaud YR. An exploratory analysis of spine patients’ preoperative concerns and decision-making process: Does what surgeons say matter? Spine (Phila Pa 1976) 2020;45:1067-72.
17. Tabibian BE, Kuhn EN, Davis MC, Pritchard PR. Patient expectations and preferences in the spinal surgery clinic. World Neurosurg 2017;106:595-601.
18. Shaw J, Baker M. “Expert patient” dream or nightmare? BMJ 2004;328:723-4.
19. Endean A, Palmer KT, Coggon D. Potential of mri findings to refine case definition for mechanical low back pain in epidemiological studies: A systematic review. Spine (Phila Pa 1976) 2011;36:160-9.
20. Modic MT. Modic type 1 and type 2 changes. J Neurosurg Spine 2007;6: 150-1; discussion 151.
21. Vital JM, Gille O, Pointillart V, Pedram M, Bacon P, Razanabola F, et al. Course of Modic 1 six months after lumbar posterior osteosynthesis. Spine (Phila Pa 1976) 2003;28:715-20; discussion 721.
22. Du bousset J, Ilharreborde B, Le Huec JC. Use of EOS imaging for the assessment of scoliosis deformities: Application to postoperative 3D quantitative analysis of the trunk. European Spine Journal 2014;23: S397-S405.
23. Roussouly P, Nnadi C. Sagittal plane deformity: An overview of interpretation and management. European Spine Journal 2010;19: 1824-36.
24. Gunzburg R. Spinal balance: The toll of bipedalism or the “French Connection.” Eur Spine J 2014;23:1383.
25. Iyer S, Sheha E, Fu MC, Varghese J, Cunningham ME, Albert TJ, et al. Sagittal spinal alignment in adult spinal deformity: An overview of current concepts and a critical analysis review. JBJS Reviews 2018;6:e2.
26. Kindrachuk DR, Fourney DR. Spine surgery referrals redirected through a multidisciplinary care pathway: Effects of nonsurgeon triage including MRI utilization. J Neurosurg Spine 2014;20: 87-92.
27. Murphy C, French H, McCarthy G, Cunningham C. Clinical pathways for the management of low back pain from primary to specialised care: a systematic review. Eur Spine J 2022;31:1846-65.
28. SFCR. In: SFCR [Internet]. [cité le 3 août 2022]. https://www.sfcr.fr/
29. Msika C. Robert Merle d’Aubigné : le gentleman qui porta l’orthopédie-traumatologie française sur ses fonts baptismaux. https://www.sofcot.fr/sites/www.sofcot.fr/files/medias/documents/3%20Robert%20Merle%20d%27Aubign%C3%A9.pdf
30. Janssen SJ, Bredenoord AL, Dhert W, de Kleuver M, Oner FC, Verlaan J-J. Potential conflicts of interest of editorial board members from five leading spine journals. PLoS One 2015;10: e0127362.
31. Activité établissement - Casemix MCO | Stats ATIH [cité le 26 février 2019]. https://www.scansante.fr/applications/casemix_ghm_cmd?secteur=MCO
32. Challier V, Boissiere L, Obeid I, Vital J-M, Castelain J-E, Bénard A, et al. One-level lumbar degenerative spondylolisthesis and posterior approach: Is transforaminal lateral interbody fusion mandatory? Spine 2017;42: 531-9.
33. Staartjes VE, Klukowska AM, Sorba EL, Schröder ML. Conflicts of interest in randomized controlled trials reported in neurosurgical journals. Journal of Neurosurgery 2019;133:855-64.
34. Wan ZY, Shan H, Liu TF, Song F, Zhang J, Liu ZH, et al. Emerging issues questioning the current treatment strategies for lumbar disc herniation. Front Surg 2022;9:814531.
35. Bailey CS, Rasoulinejad P, Taylor D, Sequeira K, Miller T, Watson J, et al. Surgery versus conservative care for persistent sciatica lasting 4 to 12 months. N Engl J Med 2020;382:1093-102.
36. Ponkilainen VT, Mäntymäki H, Huttunen TT, Mattila VM. Decreasing incidence of lumbar discectomy surgery in Finland in 1997-2018. Spine (Phila Pa 1976) 2021;46:383-90.
37. Gille O, De Azevedo Oliveira B, Guerin P, Lepreux S, Richez C, Vital JM. Regression of giant cell tumor of the cervical spine with bisphosphonate as single therapy. Spine 2012;37: E396-E399.
38. Debono B, Sabatier P, Koudsie A, Buffenoir K, Hamel O. Managing spine surgery referrals: The consultation of neurosurgery and its nuances. Neurochirurgie 2017;63:267-72.
39. Lubelski D, Williams SK, O’Rourke C, Obuchowski NA, Wang JC, Steinmetz MP, et al. Differences in the surgical treatment of lower back pain among spine surgeons in the United States. Spine 2016;41:978-86.
40. Petersen T, Juhl CB, Fournier GL. Patients with persistent low back pain and nerve root involvement: To operate, or not to operate, that is the question. Spine (Phila Pa 1976) 2020;45:483-90.
41. Lenza M, Buchbinder R, Staples MP, Dos Santos OFP, Brandt RA, Lottenberg CL, et al. Second opinion for degenerative spinal conditions: An option or a necessity? A prospective observational study. BMC Musculoskelet Disord 2017;18:354.
42. Fisher CG, Vaccaro AR, Patel AA, Whang PG, Thomas KC, Chi J, et al. Evidence-based recommendations for spine surgery. Spine (Phila Pa 1976) 2020;45:851-9.
43. Austevoll IM, Hermansen E, Fagerland MW, Storheim K, Brox JI, Solberg T, et al. Decompression with or without fusion in degenerative lumbar spondylolisthesis. N Engl J Med 2021;385:526-38.
44. Andrade NS, Flynn JP, Bartanusz V. Twenty-year perspective of randomized controlled trials for surgery of chronic nonspecific low back pain: Citation bias and tangential knowledge. Spine J 2013;13:1698-704.
45. Cabana MD, Rand CS, Powe NR, Wu AW, Wilson MH, Abboud PA, et al. Why don’t physicians follow clinical practice guidelines? A framework for improvement. JAMA 1999;282:1458-65.
46. Debono B, Lonjon G, Galovich LA, Kerever S, Guiot B, Eicker S-O, et al. Indication variability in degenerative lumbar spine surgery: A four-nation survey. Spine 2018;43:185-92.
47. Epstein NE, Hood DC. “Unnecessary” spinal surgery: A prospective 1-year study of one surgeon’s experience. Surg Neurol Int 2011;2:83.
48. Daniels AH, Ruttiman R, Eltorai AEM, DePasse JM, Brea BA, Palumbo MA. Malpractice litigation following spine surgery. J Neurosurg Spine 2017;27:470-5.
49. Nahed BV, Babu MA, Smith TR, Heary RF. Malpractice liability and defensive medicine: A national survey of neurosurgeons. PLoS One 2012;7.
50. Din RS, Yan SC, Cote DJ, Acosta MA, Smith TR. Defensive medicine in U.S. spine neurosurgery. Spine 2017;42:177-85.
51. Caton J Orthorisq ou la naissance d'un nouveau concept de gestion des risques médicaux. Rev Chir Orthop Rep App Loc 2007;96(1) SS.6.
52. Guillain A, Moncany A-H, Hamel O, Gerson C, Bougeard R, Dran G, et al. Spine neurosurgeons facing the judicialization of their profession: Disenchantment and alteration of daily practice-a qualitative study. Acta Neurochir (Wien) 2020.
53. Kirkaldy-Willis WH, Wedge JH, Yong-Hing K, Reilly J. Pathology and pathogenesis of lumbar spondylosis and stenosis. Spine (Phila Pa 1976) 1978;3:319-28.
54. Mancuso CA, Duculan R, Cammisa FP, Sama AA, Hughes AP, Lebl DR, et al. Concordance between patients’ and surgeons’ expectations of lumbar surgery. Spine (Phila Pa 1976) 2021;46:249-58.
2. Deyo RA, Mirza SK, Martin BI. Back pain prevalence and visit rates: Estimates from U.S. national surveys, 2002. Spine 2006;31:2724-7.
3. Arana E, Kovacs FM. The evidence gap in low back pain management strategies. Lancet 2021;398:1130-1.
4. Wilgenbusch CS, Wu AS, Fourney DR. Triage of spine surgery referrals through a multidisciplinary care pat hway: A value-based comparison with conventional referral processes. Spine 2014;39:S129-135.
5. Simonnet G, Laurent B, Le Breton D. L’homme douloureux. Éditions Odile Jacob, Paris 2019.
6. Vital JM, Boudissa M, Campana M. Surgery for chronic low back pain: Good option? Better than conservative treatment? Bull Acad Natl Med 2015;199:1367-82.
7. Havakeshian S, Mannion AF. Negative beliefs and psychological disturbance in spine surgery patients: A cause or consequence of a poor treatment outcome? Eur Spine J 2013;22:2827-35.
8. Hall H. Effective spine triage: Patterns of pain. Ochsner J 2014;14: 88-95.
9. Khor S, Lavallee D, Cizik AM, Bellabarba C, Chapman JR, Howe CR, et al. Development and validation of a prediction model for pain and functional outcomes after lumbar spine surgery. JAMA Surgery 2018;153: 634-42.
10. Mannion AF, Junge A, Elfering A, Dvorak J, Porchet F, Grob D. Great expectations: Really the novel predictor of outcome after spinal surgery? Spine (Phila Pa 1976) 2009;34: 1590-9.
11. Linton AA, Hsu WK. A review of treatment for acute and chronic pars fractures in the lumbar spine. Curr Rev Musculoskelet Med 2022;15:259-71.
12. Macnab I. Negative disc exploration. An analysis of the causes of nerve-root involvement in sixty-eight patients. J Bone Joint Surg Am 1971;53:891-903.
13. Porchet F, Lattig F, Grob D, Kleinstueck FS, Jeszenszky D, Paus C, et al. Comparison of patient and surgeon ratings of outcome 12 months after spine surgery: Presented at the 2009 Joint Spine Section Meeting. J Neurosurg Spine 2010;12: 447-55.
14. Aljawadi A, Sethi G, Islam A, Elmajee M, Pillai A. Sciatica presentations and predictors of poor outcomes following surgical decompression of herniated lumbar discs: A review article. Cureus. 12: e11605.
15. Truog RD. Patients and doctors - The evolution of a relationship. N Engl J Med 2012;366: 581-5.
16. Matthies N, Keshen S, Lewis S, Webster F, Perruccio AV, Rampersaud YR. An exploratory analysis of spine patients’ preoperative concerns and decision-making process: Does what surgeons say matter? Spine (Phila Pa 1976) 2020;45:1067-72.
17. Tabibian BE, Kuhn EN, Davis MC, Pritchard PR. Patient expectations and preferences in the spinal surgery clinic. World Neurosurg 2017;106:595-601.
18. Shaw J, Baker M. “Expert patient” dream or nightmare? BMJ 2004;328:723-4.
19. Endean A, Palmer KT, Coggon D. Potential of mri findings to refine case definition for mechanical low back pain in epidemiological studies: A systematic review. Spine (Phila Pa 1976) 2011;36:160-9.
20. Modic MT. Modic type 1 and type 2 changes. J Neurosurg Spine 2007;6: 150-1; discussion 151.
21. Vital JM, Gille O, Pointillart V, Pedram M, Bacon P, Razanabola F, et al. Course of Modic 1 six months after lumbar posterior osteosynthesis. Spine (Phila Pa 1976) 2003;28:715-20; discussion 721.
22. Du bousset J, Ilharreborde B, Le Huec JC. Use of EOS imaging for the assessment of scoliosis deformities: Application to postoperative 3D quantitative analysis of the trunk. European Spine Journal 2014;23: S397-S405.
23. Roussouly P, Nnadi C. Sagittal plane deformity: An overview of interpretation and management. European Spine Journal 2010;19: 1824-36.
24. Gunzburg R. Spinal balance: The toll of bipedalism or the “French Connection.” Eur Spine J 2014;23:1383.
25. Iyer S, Sheha E, Fu MC, Varghese J, Cunningham ME, Albert TJ, et al. Sagittal spinal alignment in adult spinal deformity: An overview of current concepts and a critical analysis review. JBJS Reviews 2018;6:e2.
26. Kindrachuk DR, Fourney DR. Spine surgery referrals redirected through a multidisciplinary care pathway: Effects of nonsurgeon triage including MRI utilization. J Neurosurg Spine 2014;20: 87-92.
27. Murphy C, French H, McCarthy G, Cunningham C. Clinical pathways for the management of low back pain from primary to specialised care: a systematic review. Eur Spine J 2022;31:1846-65.
28. SFCR. In: SFCR [Internet]. [cité le 3 août 2022]. https://www.sfcr.fr/
29. Msika C. Robert Merle d’Aubigné : le gentleman qui porta l’orthopédie-traumatologie française sur ses fonts baptismaux. https://www.sofcot.fr/sites/www.sofcot.fr/files/medias/documents/3%20Robert%20Merle%20d%27Aubign%C3%A9.pdf
30. Janssen SJ, Bredenoord AL, Dhert W, de Kleuver M, Oner FC, Verlaan J-J. Potential conflicts of interest of editorial board members from five leading spine journals. PLoS One 2015;10: e0127362.
31. Activité établissement - Casemix MCO | Stats ATIH [cité le 26 février 2019]. https://www.scansante.fr/applications/casemix_ghm_cmd?secteur=MCO
32. Challier V, Boissiere L, Obeid I, Vital J-M, Castelain J-E, Bénard A, et al. One-level lumbar degenerative spondylolisthesis and posterior approach: Is transforaminal lateral interbody fusion mandatory? Spine 2017;42: 531-9.
33. Staartjes VE, Klukowska AM, Sorba EL, Schröder ML. Conflicts of interest in randomized controlled trials reported in neurosurgical journals. Journal of Neurosurgery 2019;133:855-64.
34. Wan ZY, Shan H, Liu TF, Song F, Zhang J, Liu ZH, et al. Emerging issues questioning the current treatment strategies for lumbar disc herniation. Front Surg 2022;9:814531.
35. Bailey CS, Rasoulinejad P, Taylor D, Sequeira K, Miller T, Watson J, et al. Surgery versus conservative care for persistent sciatica lasting 4 to 12 months. N Engl J Med 2020;382:1093-102.
36. Ponkilainen VT, Mäntymäki H, Huttunen TT, Mattila VM. Decreasing incidence of lumbar discectomy surgery in Finland in 1997-2018. Spine (Phila Pa 1976) 2021;46:383-90.
37. Gille O, De Azevedo Oliveira B, Guerin P, Lepreux S, Richez C, Vital JM. Regression of giant cell tumor of the cervical spine with bisphosphonate as single therapy. Spine 2012;37: E396-E399.
38. Debono B, Sabatier P, Koudsie A, Buffenoir K, Hamel O. Managing spine surgery referrals: The consultation of neurosurgery and its nuances. Neurochirurgie 2017;63:267-72.
39. Lubelski D, Williams SK, O’Rourke C, Obuchowski NA, Wang JC, Steinmetz MP, et al. Differences in the surgical treatment of lower back pain among spine surgeons in the United States. Spine 2016;41:978-86.
40. Petersen T, Juhl CB, Fournier GL. Patients with persistent low back pain and nerve root involvement: To operate, or not to operate, that is the question. Spine (Phila Pa 1976) 2020;45:483-90.
41. Lenza M, Buchbinder R, Staples MP, Dos Santos OFP, Brandt RA, Lottenberg CL, et al. Second opinion for degenerative spinal conditions: An option or a necessity? A prospective observational study. BMC Musculoskelet Disord 2017;18:354.
42. Fisher CG, Vaccaro AR, Patel AA, Whang PG, Thomas KC, Chi J, et al. Evidence-based recommendations for spine surgery. Spine (Phila Pa 1976) 2020;45:851-9.
43. Austevoll IM, Hermansen E, Fagerland MW, Storheim K, Brox JI, Solberg T, et al. Decompression with or without fusion in degenerative lumbar spondylolisthesis. N Engl J Med 2021;385:526-38.
44. Andrade NS, Flynn JP, Bartanusz V. Twenty-year perspective of randomized controlled trials for surgery of chronic nonspecific low back pain: Citation bias and tangential knowledge. Spine J 2013;13:1698-704.
45. Cabana MD, Rand CS, Powe NR, Wu AW, Wilson MH, Abboud PA, et al. Why don’t physicians follow clinical practice guidelines? A framework for improvement. JAMA 1999;282:1458-65.
46. Debono B, Lonjon G, Galovich LA, Kerever S, Guiot B, Eicker S-O, et al. Indication variability in degenerative lumbar spine surgery: A four-nation survey. Spine 2018;43:185-92.
47. Epstein NE, Hood DC. “Unnecessary” spinal surgery: A prospective 1-year study of one surgeon’s experience. Surg Neurol Int 2011;2:83.
48. Daniels AH, Ruttiman R, Eltorai AEM, DePasse JM, Brea BA, Palumbo MA. Malpractice litigation following spine surgery. J Neurosurg Spine 2017;27:470-5.
49. Nahed BV, Babu MA, Smith TR, Heary RF. Malpractice liability and defensive medicine: A national survey of neurosurgeons. PLoS One 2012;7.
50. Din RS, Yan SC, Cote DJ, Acosta MA, Smith TR. Defensive medicine in U.S. spine neurosurgery. Spine 2017;42:177-85.
51. Caton J Orthorisq ou la naissance d'un nouveau concept de gestion des risques médicaux. Rev Chir Orthop Rep App Loc 2007;96(1) SS.6.
52. Guillain A, Moncany A-H, Hamel O, Gerson C, Bougeard R, Dran G, et al. Spine neurosurgeons facing the judicialization of their profession: Disenchantment and alteration of daily practice-a qualitative study. Acta Neurochir (Wien) 2020.
53. Kirkaldy-Willis WH, Wedge JH, Yong-Hing K, Reilly J. Pathology and pathogenesis of lumbar spondylosis and stenosis. Spine (Phila Pa 1976) 1978;3:319-28.
54. Mancuso CA, Duculan R, Cammisa FP, Sama AA, Hughes AP, Lebl DR, et al. Concordance between patients’ and surgeons’ expectations of lumbar surgery. Spine (Phila Pa 1976) 2021;46:249-58.