Hors dépistage, la recherche de sang occulte dans les selles fait appel à des tests immunologiques qualitatifs dont les performances sont médiocres, au contraire des tests immunologiques quantitatifs. Ces derniers, en France et à ce jour, sont réservés au dépistage organisé du cancer colorectal. Leur utilisation à visée diagnostique, pour remplacer les premiers devenus obsolètes, devrait s'imposer en pratique courante.
Avec plus de 43 000 nouveaux cas et 17 000 décès en 2018 en France, le cancer colorectal est le 3e cancer le plus fréquent et la 2e cause de mortalité par cancer.1 Bon nombre de ces décès sont pourtant évitables. Plusieurs essais contrôlés randomisés ont démontré que le dépistage périodique par recherche de sang occulte dans les selles et par recto-sigmoïdoscopie permettait de diminuer la mortalité par cancer colorectal, voire son incidence.2 Un programme national de dépistage de ce cancer a donc été organisé en France, fondé sur la réalisation d’un test de recherche de sang occulte dans les selles tous les deux ans par la population à risque moyen âgée de 50 à 74 ans. Le test au gaïac initial (Hemoccult) a été remplacé par un test immunochimique fécal (TIF) quantitatif (OC-Sensor) en 2015, ce dernier ayant fait la preuve de sa supériorité en termes d’acceptabilité et de performances.2 L’utilisation des tests de recherche de sang occulte dans les selles aux fins de dépistage organisé en population est somme toute récente. Ces tests étaient auparavant utilisés, et continuent d’être utilisés en France, à titre d’aide diagnostique chez des patients souffrant de symptômes digestifs sans que leur utilisation ne fasse l’objet de recommandations. Dans notre pays, les indications de coloscopies sont larges et reposent sur des recommandations de 2004, non actualisées et n’intégrant pas l’utilisation des tests immunochimiques.3 À l’inverse, en Angleterre4,5 et en Écosse,6 en raison de moyens contraints, les indications de coloscopies sont plus restrictives et reposent sur des recommandations régulièrement actualisées qui intègrent le taux d’hémoglobine fécale tel que mesuré par un test immunochimique quantitatif. L’objectif étant de trier, sur des critères objectifs, les personnes à risque élevé de lésion néoplasique colorectale évoluée (ou de maladie inflammatoire chronique intestinale) relevant d’investigations complémentaires, plus particulièrement d’une coloscopie (rule in) de celles à risque infime n’en nécessitant pas (rule out).
Quels patients, quels symptômes sont concernés ?
La mesure du taux d’hémoglobine fécale (THF) n’est pas pertinente en cas de symptomatologie aiguë, qu’il s’agisse du diagnostic d’un syndrome douloureux abdominal aigu, d’une gastroentérite ou d’une hémorragie digestive abondante aiguës. Elle n’est pas non plus une aide au diagnostic de symptômes chroniques et/ou anciens tels que troubles fonctionnels intestinaux. Dans ce cas, en revanche, la mesure biennale du THF est recommandée et possible dans le cadre du dépistage organisé du cancer colique chez les 50-74 ans à risque moyen. L’objet de cet article est d’évaluer l’intérêt de mesurer le THF pour aider au diagnostic de symptômes généraux (altération de l’état général, amaigrissement, anémie ferriprive) et digestifs bas (douleurs abdominales, modification du transit, diarrhée, constipation, masse palpable, rectorragies) d’apparition récente chez l’adulte. Pour les douleurs abdominales et troubles du transit, il est entendu que doser le THF n’est pas indiqué d’emblée, mais seulement si les symptômes se prolongent au-delà de 2 à 4 semaines malgré un traitement symptomatique bien conduit.
Hémoglobine fécale : les fondamentaux
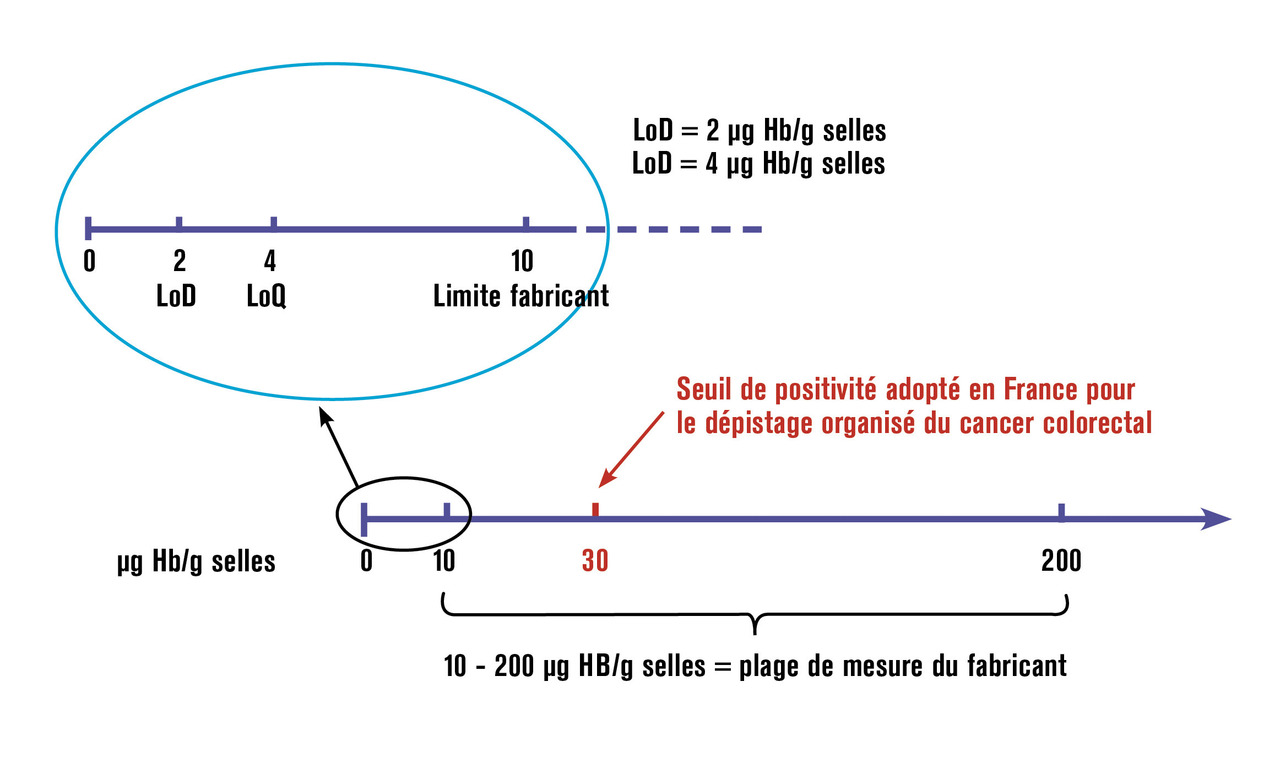
Il existe une perte physiologique de sang dans les selles (inférieure à 1 mL/j) avec d’importantes variations physiologiques du THF.7 Les recommandations internationales sont d’exprimer le THF en µg Hb/g de selles, que nous simplifierons en µg/g pour la suite de l’article. Le THF augmente avec l’âge, le sexe masculin, le faible niveau socio-économique, et varie selon le pays (et même la région), la race, le groupe ethnique, et le type de test utilisé.7 La moitié de la population écossaise âgée de 50 à 74 ans n’a pas de sang détectable par test immunochimique fécal quantitatif et plus de 90 % ont un THF inférieur à 20 µg /g. Aussi, bien que tout le monde ait, plus ou moins, du sang occulte dans les selles, on peut considérer en pratique qu’une personne saine n’a pas de sang détectable par test immunochimique quantitatif et que toute hémoglobine détectable doit être considérée comme inhabituelle.7 Le seuil de détection (limit of detection [LoD]) varie selon les tests commercialisés. Il est de 2 µg/g pour le test OC-Sensor utilisé pour le programme français de dépistage organisé du cancer colorectal. Le risque de néoplasie colorectale augmente dès que du sang est détectable, le THF augmentant principalement avec la taille de la lésion, mais aussi sa forme pédiculée et sa localisation distale.2 Enfin, le THF a une valeur pronostique puisqu’il est corrélé au risque ultérieur de cancer colorectal, de décès par cancer colique et de décès toutes causes.2 Les tests immunochimiques fécaux détectent spécifiquement la globine humaine, composant protéique de l’hémoglobine, et ses produits précoces de dégradation. Ils sont quasi spécifiques des saignements colorectaux car la globine d’origine plus proximale est dégradée dans le tractus digestif. Le seuil de positivité adopté en France pour le dépistage organisé du cancer colique est de 30 µg/g, alors qu’il était de 150 µg/g avec le test Hemoccult.2
Tests qualitatifs
Les tests immunochimiques fécaux qualitatifs, tels que pratiqués en France par les laboratoires de biologie médicale, reposent sur une technique d’immunochromatographie, comme les tests de grossesse. Ils sont cotés B20, soit 5,40 €. Leur lecture est visuelle, subjective, nécessitant du personnel entraîné, le respect strict des consignes du fabricant quant au délai de lecture. Ils fournissent un résultat binaire, positif ou négatif. Leur seuil de positivité est fixé par le fabricant et varie considérablement selon les tests, de sorte que le taux de positivité varie lui aussi considérablement, de 6 à 47 % dans une étude portant sur six tests différents évalués dans un programme de dépistage du cancer colorectal.8 Dans ce contexte, leur sensibilité pour la détection d’une néoplasie avancée (cancer colorectal ou adénome avancé, c’est-à-dire adénome ≥ 10 mm ou en dysplasie de haut grade ou villeux ou tubulo-villeux) varie donc tout autant (30 à 73 %).8 En population symptomatique, la sensibilité pour le cancer colorectal de quatre tests différents, réalisés sur trois prélèvements successifs, variait de 82 à 100 % selon le test immunochimique qualitatif, avec des taux de positivité variant de 22 à 35 %.9 Sur 26 tests immunochimiques commercialisés aux États-Unis, seuls 13 (11 qualitatifs et deux quantitatifs) ont fait l’objet d’un programme de vérification des performances, et seuls quatre ont vu leurs performances évaluées en population avec une coloscopie comme étalon or, les tests quantitatifs s’avérant supérieurs aux tests qualitatifs.10
Tests quantitatifs
Les tests immunochimiques quantitatifs utilisent une technique d’immunoturbidimétrie. Leur lecture est automatisée et fournit un résultat quantitatif sous forme d’un THF exprimé en µg Hb/g de selles. Plusieurs sont commercialisés mais seuls quatre sont utilisés dans des programmes de dépistage organisé du cancer colorectal, dont le test OC-Sensor, exclusivement réservé au dépistage organisé en France. Le fabricant de ce test recommande une plage de mesure de 10 à 200 µg/g correspondant à sa zone de linéarité (v . figure ). En fait, tout bon laboratoire doit être capable d’exploiter le potentiel maximal du test, en particulier en dessous de 10 µg/g, jusqu’à la LoQ (limite de quantification) à 4 µg/g et la LoD (limite de détection) à 2 µg/g.11 En effet, les valeurs de THF situées entre 2 et 10 µg/g ne sont pas strictement « normales » et ont une valeur diagnostique et pronostique exploitable en pratique courante pour la prise en charge d’un patient (par opposition à leur utilisation pour dépistage en population asymptomatique).11 Leurs performances cliniques sont parfaitement évaluées et connues en programme de dépistage chez les personnes asymptomatiques à risque moyen de cancer colorectal, variant selon le seuil de positivité choisi. Au seuil de 10 µg/g, leur sensibilité pour le cancer colorectal est de 91 % (40 % pour l’adénome avancé). Au seuil de 20 µg/g, leur sensibilité pour le cancer colorectal est de 75 % (25 % pour l’adénome avancé).12
Rendement de la coloscopie en cas de symptômes
La valeur prédictive positive (VPP) pour un cancer colorectal des symptômes digestifs observés en première ligne, chez le médecin généraliste, est faible, variant de 3 à 8 % selon les symptômes (douleur abdominale 3,3 %, anémie 7,0 %, rectorragies 8,1 %).13 Une revue systématique avec méta-analyse n’a retenu que deux symptômes dont la VPP pour le cancer colorectal était supérieure ou égale à 5 % avec un niveau de preuve robuste : les rectorragies après 75 ans et l’anémie ferriprive avec des seuils d’âge de 60 et 70 ans selon le taux d’Hb et le sexe.14 Les autres symptômes, douleur abdominale, constipation, diarrhée et modification de transit, étaient non discriminants, car aussi fréquents chez les personnes avec et sans cancer colorectal.15 Somme toute, pour bon nombre de ces symptômes, tels que constipation, diarrhée et douleur abdominale, leur présence est associée à un risque de cancer colorectal inférieur à celui observé lors de coloscopies de dépistage chez des personnes asymptomatiques.15 Ce ne sont donc pas, isolément, de bonnes indications de coloscopie.
Scores symptomatiques
Les limites de l’utilisation des symptômes comme critère pour référer au gastro-entérologue pour un diagnostic précoce de cancer colorectal ont conduit à l’élaboration de recommandations et de scores qui incorporent, outre les symptômes, des données démographiques, anamnestiques personnelles et familiales, et paracliniques. Le premier était le TWW (two-week wait) proposé par le National Health Service (NHS) en Angleterre en 2000. Il a été actualisé en 2005 par le National Institute for Health and Clinical Excellence (NICE guidelines) et de nombreux autres scores ont été proposés tels que Scottish Intercollegiate Guidelines Network (SIGN), Cancer Prediction in Exeter (CAPER score), Bristol-Birmingham equation (BB), QCancer (colon), etc. Une revue récente de 15 scores, dont 9 utilisés en « soins primaires », a montré que seuls 4 avaient un bon pouvoir discriminant (aire sous la courbe ROC [AUROC] > 0,8) dans des études de validation externe.16 Tous avaient des performances supérieures à celles des NICE guidelines de 2005.16 Ces scores sont dédiés à une gestion optimale des ressources pour le diagnostic précoce de cancer colorectal : trier les personnes à risque élevé de cancer colorectal qui relèvent d’une coloscopie, éventuellement urgente, des personnes à risque négligeable. Leur pouvoir discriminant est nettement supérieur pour le diagnostic de cancer colorectal que pour celui d’adénome avancé, reflet d’un risque de futur cancer colorectal.16
Malgré leurs bonnes performances, le pouvoir discriminant de tous ces scores et recommandations pour les diagnostics de cancer colorectal et d’adénome avancé est toujours nettement inférieur à celui de la mesure du THF, soit isolée, soit combinée à d’autres paramètres, tels que sexe, âge, etc.15-18
Malgré leurs bonnes performances, le pouvoir discriminant de tous ces scores et recommandations pour les diagnostics de cancer colorectal et d’adénome avancé est toujours nettement inférieur à celui de la mesure du THF, soit isolée, soit combinée à d’autres paramètres, tels que sexe, âge, etc.15-18
Utilisation diagnostique des tests immuno-chimiques quantitatifs
L’utilisation du test au gaïac (Hemoccult) était interdite pour l’exploration de symptômes digestifs en raison d’une sensibilité nettement insuffisante. Les Écossais ont, les premiers, exploré l’intérêt d’évaluer le THF chez des personnes symptomatiques. Les modalités d’utilisation des tests immunochimiques fécaux quantitatifs à visée diagnostique sont radicalement différentes de celles du dépistage (tableau 1 ). Le THF, mesuré par test immunochimique quantitatif, permet de répondre à deux questions : une coloscopie est-elle nécessaire ? est-elle urgente ? Les recommandations du NICE sont régulièrement actualisées et ont introduit la mesure du THF par test immunochimique quantitatif (au seuil de 10 µg/g) parmi les critères pour référer les patients symptomatiques au gastro-entérologue en 2017.5 Deux revues et méta-analyses récentes ont montré que la sensibilité du test OC-Sensor pour le diagnostic de cancer colorectal chez les patients symptomatiques était de 92,1 % au seuil de 10 µg/g.19, 20 Sur 1 000 patients symptomatiques testés, 20,9 % auraient eu un test positif, dont 30 avec cancer colorectal (VPP : 14,4 %), 79,1 % un test négatif, dont deux avec cancer colorectal manqué.19 Un total de 75 à 80 % de coloscopies étaient évitées, au prix de deux cancers colorectaux manqués sur 1 000 patients.19 La sensibilité du test OC-Sensor au seuil de 10 µg/g atteignait 94,1 % dans les études incluant exclusivement des patients symptomatiques (la sensibilité du test immunochimique pour le diagnostic de cancer colorectal est toujours significativement plus élevée, pour un même seuil, chez les patients symptomatiques que chez les personnes asymptomatiques).20 On peut cependant considérer qu’une telle sensibilité, si élevée soit elle, est insuffisante chez un patient symptomatique. Dans ce cas, l’objectif est de diagnostiquer tous les cancers colorectaux, quoi qu’il en coûte, c’est-à-dire d’atteindre une sensibilité proche de 100 % (100 % étant par définition impossible, même en réalisant une coloscopie à tous les patients, la coloscopie manquant, elle aussi, des cancers21). La plupart des études s’appuient sur une valeur prédictive négative (VPN) pour le cancer colorectal très élevée, proche de 100 %, pour considérer le risque de manquer un cancer comme négligeable. En fait, la VPN est trompeuse, car forcément très élevée eu égard à la relativement faible prévalence du cancer colorectal dans les populations étudiées, symptomatiques ou non. En pratique clinique, l’objectif est de réduire à zéro (ou presque) le risque de manquer un cancer colorectal, mesuré par 1 - sensibilité, au prix d’un nombre minimal de coloscopies (donc de tests « positifs »). Il est possible d’améliorer la sensibilité du test immunochimique fécal en abaissant le seuil qui détermine la réalisation d’une coloscopie. Le tableau 2 résume les performances diagnostiques des tests immunochimiques pour le diagnostic de cancer colorectal selon le seuil adopté. Pour mémoire, la sensibilité pour le cancer colorectal supérieure à 97 % obtenue par un test immunochimique au seuil de 2 µg/g est équivalente, voire supérieure à celle de la coloscopie.21, 22
Un THF très faible confère un risque infime de cancer colorectal, pas un risque nul. Le THF ne doit donc jamais être utilisé seul pour éliminer le diagnostic de cancer colorectal. Il doit être interprété en tenant compte de tous les éléments cliniques (type de symptômes, sexe, âge) mais aussi paracliniques (hémogramme, bilan martial). La moitié des faux négatifs du THF ont une anémie ferriprive qui permet de redresser le diagnostic.23, 24 De plus, en cas de symptômes sévères, persistants ou s’aggravant, il ne faut pas être faussement rassuré par un THF très faible et au contraire référer au gastro-entérologue qui jugera de la pertinence d’investigations supplémentaires, dont la coloscopie.25 Ponctuellement, dans ce cas, il est possible de refaire un test immunochimique fécal à distance du premier pour guider sa stratégie diagnostique sur le résultat du deuxième prélèvement (ce qui est absolument interdit dans le cadre du dépistage organisé du cancer colorectal).25 Enfin, le THF n’est pas suffisamment sensible pour exclure d’autres lésions colorectales significatives, telles qu’un adénome avancé ou une maladie inflammatoire chronique intestinale.
Paradoxalement, l’intérêt diagnostique du THF reste entier pour l’exploration de symptômes hémorragiques, rectorragies et anémie ferriprive. Les recommandations françaises de 2004 considéraient la coloscopie comme impérative en cas de rectorragies après 50 ans.3 Dans une série de 462 patients ayant des rectorragies, 168 (36,4 %) avaient un THF inférieur à 10 µg/g, dont un cas de cancer colorectal du côlon distal.26 Les auteurs concluent qu’un patient avec rectorragies et THF inférieur à 10 µg/g peut être exploré par examen proctologique et recto-sigmoïdoscopie seuls, sans recours à la coloscopie. Une autre étude portant sur 3 143 patients ayant des rectorragies a montré que 56 % d’entre eux n’avaient pas d’hémoglobine fécale détectable (< 2 µg/g) et avaient un risque de cancer colorectal de 0,1 %, réduit à 0,03 % par la réalisation d’une recto-sigmoïdoscopie.27
De même, en cas d’anémie ferriprive chez l’homme et la femme ménopausée, une stratégie reposant sur la réalisation d’une gastroscopie et d’un test immunochimique fécal quantitatif, la coloscopie étant conditionnée par un THF supérieur ou égal à 15 µg/g, a permis de détecter tous les cancers, gastro-duodénaux et colorectaux (et 92,4 % des lésions significatives hautes et basses) en évitant 71,6 % de coloscopies.28
Si le THF est très élevé, la coloscopie est urgente et prioritaire, en particulier dans un contexte de déprogrammation occasionné par la pandémie de Covid-19. L’Angleterre et l’Écosse ont retenu respectivement les seuils de 100 et 400 µg/g pour l’indication d’investigations urgentes.25 Un seuil de 150 µg/g pourrait être retenu en France. Ce taux avait une VPP pour le cancer colorectal supérieure à 13 % dans les deux sexes dans une série de plus de 13 000 coloscopies de dépistage pour test immunochimique fécal positif en Alsace et atteignait 31 % dans une série anglaise de patients symptomatiques.22
Un THF très faible confère un risque infime de cancer colorectal, pas un risque nul. Le THF ne doit donc jamais être utilisé seul pour éliminer le diagnostic de cancer colorectal. Il doit être interprété en tenant compte de tous les éléments cliniques (type de symptômes, sexe, âge) mais aussi paracliniques (hémogramme, bilan martial). La moitié des faux négatifs du THF ont une anémie ferriprive qui permet de redresser le diagnostic.23, 24 De plus, en cas de symptômes sévères, persistants ou s’aggravant, il ne faut pas être faussement rassuré par un THF très faible et au contraire référer au gastro-entérologue qui jugera de la pertinence d’investigations supplémentaires, dont la coloscopie.25 Ponctuellement, dans ce cas, il est possible de refaire un test immunochimique fécal à distance du premier pour guider sa stratégie diagnostique sur le résultat du deuxième prélèvement (ce qui est absolument interdit dans le cadre du dépistage organisé du cancer colorectal).25 Enfin, le THF n’est pas suffisamment sensible pour exclure d’autres lésions colorectales significatives, telles qu’un adénome avancé ou une maladie inflammatoire chronique intestinale.
Paradoxalement, l’intérêt diagnostique du THF reste entier pour l’exploration de symptômes hémorragiques, rectorragies et anémie ferriprive. Les recommandations françaises de 2004 considéraient la coloscopie comme impérative en cas de rectorragies après 50 ans.3 Dans une série de 462 patients ayant des rectorragies, 168 (36,4 %) avaient un THF inférieur à 10 µg/g, dont un cas de cancer colorectal du côlon distal.26 Les auteurs concluent qu’un patient avec rectorragies et THF inférieur à 10 µg/g peut être exploré par examen proctologique et recto-sigmoïdoscopie seuls, sans recours à la coloscopie. Une autre étude portant sur 3 143 patients ayant des rectorragies a montré que 56 % d’entre eux n’avaient pas d’hémoglobine fécale détectable (< 2 µg/g) et avaient un risque de cancer colorectal de 0,1 %, réduit à 0,03 % par la réalisation d’une recto-sigmoïdoscopie.27
De même, en cas d’anémie ferriprive chez l’homme et la femme ménopausée, une stratégie reposant sur la réalisation d’une gastroscopie et d’un test immunochimique fécal quantitatif, la coloscopie étant conditionnée par un THF supérieur ou égal à 15 µg/g, a permis de détecter tous les cancers, gastro-duodénaux et colorectaux (et 92,4 % des lésions significatives hautes et basses) en évitant 71,6 % de coloscopies.28
Si le THF est très élevé, la coloscopie est urgente et prioritaire, en particulier dans un contexte de déprogrammation occasionné par la pandémie de Covid-19. L’Angleterre et l’Écosse ont retenu respectivement les seuils de 100 et 400 µg/g pour l’indication d’investigations urgentes.25 Un seuil de 150 µg/g pourrait être retenu en France. Ce taux avait une VPP pour le cancer colorectal supérieure à 13 % dans les deux sexes dans une série de plus de 13 000 coloscopies de dépistage pour test immunochimique fécal positif en Alsace et atteignait 31 % dans une série anglaise de patients symptomatiques.22
Scores mixtes associant THF et facteurs cliniques
Les Espagnols ont, les premiers, exploré l’intérêt d’associer le THF à des facteurs cliniques pour l’élaboration de scores prédictifs de cancer colorectal chez des personnes symptomatiques.17 Trois scores ont été évalués : COLONPREDICT (11 variables), FAST (3 variables) et COLONOFIT (5 variables, 3 mesures de THF). Tous ont des AUROC pour les diagnostics de cancer colorectal et de néoplasie avancée supérieures à celles des symptômes et des scores symptomatiques.
Le score FAST, associant sexe, âge et THF, semblait séduisant car simple à calculer automatiquement dès le laboratoire. En fait, en l’état, son intérêt est réduit en routine car il ne limite que faiblement le nombre de coloscopies à réaliser (seuls 12 à 19 % des patients ne nécessitent pas de coloscopie),18, 29 principalement parce qu’il n’exploite pas au mieux le potentiel diagnostique des THF faibles inférieurs à 20 µg/g.30 Les deux autres scores ont une meilleure AUROC mais sont plus compliqués à calculer.18, 31 Enfin, le THF seul semble avoir un pouvoir discriminant au moins équivalent à celui des scores plus complexes.18, 32 Il pourrait être encore amélioré car sa précision diagnostique est meilleure avec deux ou trois mesures qu’avec une seule.25,31 En effet, le saignement des lésions néoplasiques est intermittent et/ou d’intensité variable et l’analyse porte sur un échantillon minime de selle au sein de laquelle le sang est réparti de façon hétérogène.2 Multiplier les prélèvements permet d’augmenter les chances de détecter un saignement pathologique. Le choix de limiter à un seul le nombre de prélèvements dans les programmes de dépistage organisé du cancer colorectal a été fait pour privilégier l’acceptabilité du dépistage, donc la participation d’une population asymptomatique, non demandeuse. La situation pourrait sembler différente lorsqu’il s’agit d’explorer une personne symptomatique, demandeuse d’être soulagée de ses symptômes. Que ce soit pour l’individu ou pour la collectivité, il pourrait sembler préférable de réaliser deux ou trois mesures de THF pour déterminer s’il est nécessaire de faire une coloscopie à bon escient que de subir une coloscopie inutile. Cependant, multiplier les prélèvements n’est pas sans inconvénients (stabilité, délai d’obtention du résultat, coût…) et il est toujours possible d’obtenir la même sensibilité avec un seul prélèvement qu’avec plusieurs en diminuant le seuil de positivité. De plus, la tendance internationale est lourde en faveur d’un prélèvement unique et il y a peu de données dans la littérature pour promouvoir des prélèvements multiples.33
Le score FAST, associant sexe, âge et THF, semblait séduisant car simple à calculer automatiquement dès le laboratoire. En fait, en l’état, son intérêt est réduit en routine car il ne limite que faiblement le nombre de coloscopies à réaliser (seuls 12 à 19 % des patients ne nécessitent pas de coloscopie),18, 29 principalement parce qu’il n’exploite pas au mieux le potentiel diagnostique des THF faibles inférieurs à 20 µg/g.30 Les deux autres scores ont une meilleure AUROC mais sont plus compliqués à calculer.18, 31 Enfin, le THF seul semble avoir un pouvoir discriminant au moins équivalent à celui des scores plus complexes.18, 32 Il pourrait être encore amélioré car sa précision diagnostique est meilleure avec deux ou trois mesures qu’avec une seule.25,31 En effet, le saignement des lésions néoplasiques est intermittent et/ou d’intensité variable et l’analyse porte sur un échantillon minime de selle au sein de laquelle le sang est réparti de façon hétérogène.2 Multiplier les prélèvements permet d’augmenter les chances de détecter un saignement pathologique. Le choix de limiter à un seul le nombre de prélèvements dans les programmes de dépistage organisé du cancer colorectal a été fait pour privilégier l’acceptabilité du dépistage, donc la participation d’une population asymptomatique, non demandeuse. La situation pourrait sembler différente lorsqu’il s’agit d’explorer une personne symptomatique, demandeuse d’être soulagée de ses symptômes. Que ce soit pour l’individu ou pour la collectivité, il pourrait sembler préférable de réaliser deux ou trois mesures de THF pour déterminer s’il est nécessaire de faire une coloscopie à bon escient que de subir une coloscopie inutile. Cependant, multiplier les prélèvements n’est pas sans inconvénients (stabilité, délai d’obtention du résultat, coût…) et il est toujours possible d’obtenir la même sensibilité avec un seul prélèvement qu’avec plusieurs en diminuant le seuil de positivité. De plus, la tendance internationale est lourde en faveur d’un prélèvement unique et il y a peu de données dans la littérature pour promouvoir des prélèvements multiples.33
Lire aussi | Dossier progressif n° 251
Situation actuelle et perspectives en France
Actuellement, les tests immunochimiques fécaux quantitatifs étant exclusivement réservés au programme national de dépistage organisé du cancer colorectal chez les personnes asymptomatiques de 50 à 74 ans, seuls les tests immunochimiques qualitatifs sont accessibles pour une utilisation diagnostique. Une douzaine est commercialisée en France, dont les performances cliniques sont hétérogènes et inconnues des prescripteurs. En 2019 dans le Grand Est (5,5 millions d’habitants, 8,5 % de la population française), 41 900 tests immunochimiques qualitatifs étaient remboursés par l’Assurance maladie chez 18 500 patients (2,3 prélèvements par patient). Ces tests étaient réalisés avant 50 ans (26 %), entre 50 et 74 ans (41 % qui auraient pu bénéficier d’un test immunochimique quantitatif dans le cadre du dépistage organisé du cancer colorectal) et après 75 ans (33 %), chez la femme dans 58 % des cas. En 2019 en Alsace (1,9 million d’habitants), 8 445 patients effectuaient un test immunochimique qualitatif alors que 91 800 personnes étaient dépistées par test immunochimique quantitatif et 3 150 bénéficiaient d’une coloscopie pour test immunochimique positif dans le programme de dépistage organisé du cancer colorectal, soit 6,6 % des 47 600 coloscopies réalisées. Dans deux laboratoires de biologie médicale alsaciens, les patients réalisaient un seul prélèvement dans respectivement 52 % et 40 % des cas, deux prélèvements dans 7 % et 17 , et trois dans 45 % et 43 % des cas. Le taux de positivité était respectivement de 55 % et 45 %. Un travail de thèse réalisé au centre hospitalier de Colmar a montré qu’un test immunochimique fécal avait été prescrit chez 5 % des malades hospitalisés en 2007. Sur 200 dossiers analysés, l’indication du test immunochimique fécal était l’exploration d’une anémie dans 70 % des cas. Il était positif dans 56 % des cas (autant jouer à pile ou face avec un tel taux de positivité), seuls 30 % d’entre eux étant suivis d’une coloscopie. Il était douteux dans 11,5 % des cas, explorés dans 17 % des cas. Il était négatif dans 32,5 % des cas, 9 % d’entre eux bénéficiant néanmoins d’une coloscopie. En concertation entre cliniciens et biologistes, les tests immunochimiques fécaux qualitatifs avaient donc été supprimés des examens disponibles dans notre hôpital, sans inconvénient depuis lors. Nous ne disposons pas de données analogues sur le suivi des tests immunochimiques qualitatifs en médecine générale. Un résultat positif d’un test immunochimique qualitatif reste un motif non rare de consultation auprès du gastro-entérologue pour lequel il est source d’embarras. Un test immunochimique qualitatif positif, prescrit plus ou moins à bon escient, dont le gastro-entérologue ignore tout du test utilisé et de son seuil de positivité, doit-il conduire automatiquement à la réalisation d’une coloscopie ? La réponse est loin d’être univoque et ses conséquences médico-légales méritent d’être clarifiées. Une coloscopie « automatique » offre l’avantage d’obéir aux principes de précaution et de rentabilité financière maximales pour le gastro-entérologue. L’attitude inverse, qui suivrait la maxime selon laquelle « on ne tient jamais compte du résultat d’un examen qu’on n’aurait pas jugé utile de prescrire » est plus risquée.
Quatre propositions
L’analyse de la littérature conduit à faire quatre propositions pour une utilisation plus rationnelle des tests immunochimiques fécaux à visée diagnostique en France :
– les tests immunochimiques fécaux qualitatifs devraient être supprimés et déremboursés. Il est curieux qu’un pays aussi normatif, et supposé cartésien, que la France autorise et finance l’utilisation débridée de tests dont les performances cliniques sont inconnues et l’utilité clinique non démontrée. Quitte à prescrire un test immunochimique, autant qu’il soit quantitatif dont la lecture est fiable et les performances analytiques et cliniques parfaitement évaluées et connues. Les médecins généralistes pourraient d’ores et déjà donner un test quantitatif fourni par le programme de dépistage organisé du cancer colorectal à leurs patients symptomatiques âgés de 50 à 74 ans plutôt que de prescrire un test immunochimique qualitatif, à condition de ne pas se contenter du résultat positif/négatif fourni par le programme au seuil de 30 µg/g, mais d’adresser au gastro-entérologue toute personne ayant des symptômes récents dont le THF est ≥ 10 µg/g ;
– la prescription de tests immunochimiques fécaux quantitatifs ne devrait plus être réservée exclusivement au programme national de dépistage organisé, mais élargie à une utilisation diagnostique (objet de cet article), et à une utilisation pour un dépistage opportuniste du cancer colorectal, hors du cadre du dépistage organisé chez les personnes de 50 à 74 ans à risque moyen (par exemple chez les personnes de moins de 50 ans ayant des antécédents familiaux de cancer colorectal et celles de plus de 74 ans sans comorbidités ; non abordé dans cet article). Les tests quantitatifs devraient remplacer dès que possible les tests qualitatifs dans ces indications ;
– les laboratoires réalisant l’analyse des tests immunochimiques fécaux quantitatifs devraient rendre les résultats quantitatifs de THF inférieurs à 10 µg/g dont les valeurs diagnostique et pronostique sont actuellement inexploitées. Par exemple, pour le test OC-Sensor, les THF situés entre 4 et 10 µg/g devraient être quantifiés, ceux situés entre 2 et 4 µg/g devraient indiquer hémoglobine détectable, non quantifiable, et ceux inférieurs à 2 µg/g devraient indiquer hémoglobine non détectable ;11
– les médecins généralistes et gastroentérologues devraient apprendre à interpréter un THF. En Écosse, tout résultat de THF comporte un lien électronique avec une page Web facilitant son interprétation selon le contexte clinique.34
– les tests immunochimiques fécaux qualitatifs devraient être supprimés et déremboursés. Il est curieux qu’un pays aussi normatif, et supposé cartésien, que la France autorise et finance l’utilisation débridée de tests dont les performances cliniques sont inconnues et l’utilité clinique non démontrée. Quitte à prescrire un test immunochimique, autant qu’il soit quantitatif dont la lecture est fiable et les performances analytiques et cliniques parfaitement évaluées et connues. Les médecins généralistes pourraient d’ores et déjà donner un test quantitatif fourni par le programme de dépistage organisé du cancer colorectal à leurs patients symptomatiques âgés de 50 à 74 ans plutôt que de prescrire un test immunochimique qualitatif, à condition de ne pas se contenter du résultat positif/négatif fourni par le programme au seuil de 30 µg/g, mais d’adresser au gastro-entérologue toute personne ayant des symptômes récents dont le THF est ≥ 10 µg/g ;
– la prescription de tests immunochimiques fécaux quantitatifs ne devrait plus être réservée exclusivement au programme national de dépistage organisé, mais élargie à une utilisation diagnostique (objet de cet article), et à une utilisation pour un dépistage opportuniste du cancer colorectal, hors du cadre du dépistage organisé chez les personnes de 50 à 74 ans à risque moyen (par exemple chez les personnes de moins de 50 ans ayant des antécédents familiaux de cancer colorectal et celles de plus de 74 ans sans comorbidités ; non abordé dans cet article). Les tests quantitatifs devraient remplacer dès que possible les tests qualitatifs dans ces indications ;
– les laboratoires réalisant l’analyse des tests immunochimiques fécaux quantitatifs devraient rendre les résultats quantitatifs de THF inférieurs à 10 µg/g dont les valeurs diagnostique et pronostique sont actuellement inexploitées. Par exemple, pour le test OC-Sensor, les THF situés entre 4 et 10 µg/g devraient être quantifiés, ceux situés entre 2 et 4 µg/g devraient indiquer hémoglobine détectable, non quantifiable, et ceux inférieurs à 2 µg/g devraient indiquer hémoglobine non détectable ;11
– les médecins généralistes et gastroentérologues devraient apprendre à interpréter un THF. En Écosse, tout résultat de THF comporte un lien électronique avec une page Web facilitant son interprétation selon le contexte clinique.34
Recherche
Il reste à définir quelles seraient les modalités optimales d’utilisation diagnostique des tests immunochimiques fécaux quantitatifs en France : nombre et répartition des laboratoires équipés, test(s) utilisé(s), nombre de prélèvements, seuils de THF retenus pour ne pas poursuivre les investigations, ou au contraire réaliser une coloscopie en routine ou en urgence. Un score FAST amélioré, associant sexe, âge et une mesure de THF exploitant les taux faibles d’Hb fécale (jusqu’à la limite de détection) semble séduisant, mais reste à construire et valider.29 Dans l’attente, les capacités de réalisation de coloscopies étant, a priori, moins contraintes qu’en Grande-Bretagne, nous proposerions volontiers d’adopter en France le seuil de 4 µg/g pour déclencher le recours au gastro-entérologue en vue d’une coloscopie chez un patient symptomatique, seuil qui offre une sensibilité de 97 % pour le cancer colorectal, équivalente à celle de la coloscopie, tout en évitant une coloscopie chez les trois quarts des patients.
Conclusion
De même que les tests au gaïac ont été considérés comme obsolètes en 2015 pour le dépistage du cancer colorectal en France, les tests immunochimiques fécaux qualitatifs doivent être considérés dorénavant comme obsolètes pour quelque utilisation que ce soit. Au contraire, les tests immunochimiques quantitatifs ont, outre leur rôle primordial dans le programme national de dépistage organisé du cancer colorectal, un potentiel diagnostique totalement inexploité en France. Nous faisons dans cet article quelques propositions pour tirer le meilleur parti de ce potentiel. L’organisation mise en place depuis 2015 dans la région de Tayside en Écosse, fondée sur une coopération multidisciplinaire entre médecins généralistes, gastroentérologues et biologistes médicaux, pourrait être source d’inspiration.34 Il reviendra évidemment à la haute administration française de s’emparer du dossier pour réglementer. Nous ne doutons pas que le haut niveau de preuve accumulé dans la littérature internationale saura convaincre nos décideurs de l’impératif urgent, sanitaire et économique, de remplacer les tests qualitatifs par des tests quantitatifs et d’intégrer et de rationaliser leur utilisation diagnostique en pratique courante.
Les auteurs remercient les Drs Lionel Barrand, Pierre Adrien Bihl, Arnaud Etienne et François Mathiaux ainsi que Stéphanie Dauthel et Yassine El Kaddouri pour leur contribution à la rédaction de cet article.
Références
1. Denis B, Gendre I, Perrin P. Dépistage organisé du cancer colorectal : un bilan décevant qu’il faut améliorer. Rev Prat 2018;68:839-46.
2. Denis B, Guittet L. Dépistage du cancer colorectal par test immunologique quantitatif de recherche de sang occulte dans les selles : une révolution ? Hepato Gastro 2015;22:119-29.
3. HAu_te Autorité de santé. Endoscopie digestive basse : indications en dehors du dépistage en population. Recommandations pour la pratique clinique, HAS 2004. https://bit.ly/3blm5ES
4. NICE 2015. Suspected cancer: recognition and referral. NICE guideline [NG12]. https://www.nice.org.uk/guidance/ng12
5. NICE 2017. Quantitative faecal immunochemical tests to guide referral for colorectal cancer in primary care. Diagnostics guidance [DG30]. https://www.nice.org.uk/guidance/dg30
6. Scottish Governement. Clinical guidance on the use of faecal immunochemical testing (FIT) in the prioritisation of patients with colorectal symptoms. https://bit.ly/3f5fSOi
7. Denis B. Sang fécal occulte : quelle frontière entre physiologique et pathologique ? Hepato Gastro 2015;22:113-17.
8. Brenner H, Haug U, Hundt S. Inter-test agreement and quantitative cross-validation of immunochromatographical fecal occult blood tests. Int J Cancer 2010;127:1643-9.
9. Högberg C, Gunnarsson U, Jansson S, et al. Diagnosing colorectal cancer in primary care: cohort study in Sweden of qualitative faecal immunochemical tests, haemoglobin levels, and platelet counts. Br J Gen Pract 2020;70:e843-e851.
10. Daly JM, Xu Y, Levy BT. Which fecal immunochemical test should I choose? J Prim Care Community Health 2017;8:264-77.
11. Fraser CG, Benton SC. Detection capability of quantitative faecal immunochemical tests for haemoglobin (FIT) and reporting of low faecal haemoglobin concentrations. Clin Chem Lab Med 2019;57:611-6.
12. Imperiale TF, Gruber RN, Stump TE, et al. Performance Characteristics of Fecal Immunochemical Tests for Colorectal Cancer and Advanced Adenomatous Polyps: A Systematic Review and Meta-analysis. Ann Intern Med 2019;170:319-29.
13. Astin M, Griffin T, Neal RD, et al. The diagnostic value of symptoms for colorectal cancer in primary care: a systematic review. Br J Gen Pract 2011;61:e231-43.
14. Shapley M, Mansell G, Jordan JL, et al. Positive predictive values of ≥5% in primary care for cancer: systematic review. Br J Gen Pract 2010;60:e366-77.
15. Jellema P, van der Windt DA, Bruinvels DJ, et al. Value of symptoms and additional diagnostic tests for colorectal cancer in primary care: systematic review and meta-analysis. BMJ 2010;340:c1269.
16. Williams TG, Cubiella J, Griffin SJ, et al. Risk prediction models for colorectal cancer in people with symptoms: a systematic review. BMC Gastroenterol 2016;16:63.
17. Rodríguez-Alonso L, Rodríguez-Moranta F, Ruiz-Cerulla A, et al. An urgent referral strategy for symptomatic patients with suspected colorectal cancer based on a quantitative immunochemical faecal occult blood test. Dig Liver Dis 2015;47:797-804.
18. Herrero JM, Vega P, Salve M, et al. Symptom or faecal immunochemical test based referral criteria for colorectal cancer detection in symptomatic patients: a diagnostic tests study. BMC Gastroenterol 2018;18:155.
19. Westwood M, Lang S, Armstrong N, et al. Faecal immunochemical tests (FIT) can help to rule out colorectal cancer in patients presenting in primary care with lower abdominal symptoms: a systematic review conducted to inform new NICE DG30 diagnostic guidance. BMC Med 2017;15:189.
20. Pin Vieito N, Zarraquiños S, Cubiella J. High-risk symptoms and quantitative faecal immunochemical test accuracy: Systematic review and meta-analysis. World J Gastroenterol 2019;25:2383-401.
21. Burr NE, Derbyshire E, Taylor J, et al. Variation in post-colonoscopy colorectal cancer across colonoscopy providers in English National Health Service: population based cohort study. BMJ 2019;367:l6090.
22. D’Souza N, Georgiou Delisle T, Chen M, et al. Faecal immunochemical test is superior to symptoms in predicting pathology in patients with suspected colorectal cancer symptoms referred on a 2WW pathway: a diagnostic accuracy study. Gut 2020 Oct 21:gutjnl-2020-321956. Epub ahead of print.
23. McSorley ST, Digby J, Clyde D, et al. Yield of colorectal cancer at colonoscopy according to faecal haemoglobin concentration in symptomatic patients referred from primary care. Colorectal Dis 2020 Oct 16.
24. Mowat C, Digby J, Strachan JA, et al. Faecal haemoglobin concentration thresholds for reassurance and urgent investigation for colorectal cancer based on a faecal immunochemical test in symptomatic patients in primary care. Ann Clin Biochem 2021 Jan 21:4563220985547.
25. Benton SC, Fraser CG. Faecal immunochemical tests in the COVID-19 pandemic; safety-netting of patients with symptoms and low faecal haemoglobin concentration - can a repeat test be used? Ann Clin Biochem 2020 Oct 27:4563220967569. Epub ahead of print.
26. Digby J, Strachan JA, McCann R, et al. Measurement of faecal haemoglobin with a faecal immunochemical test can assist in defining which patients attending primary care with rectal bleeding require urgent referral. Ann Clin Biochem 2020;57:325-7.
27. Hicks G, D'Souza N, Georgiou Delisle T, et al. Using the faecal immunochemical test in patients with rectal bleeding: evidence from the NICE FIT study. Colorectal Dis 2021 Feb 19. .
28. Rodriguez-Alonso L, Rodriguez-Moranta F, Ruiz-Cerulla A, et al. The use of faecal immunochemical testing in the decision-making process for the endoscopic investigation of iron deficiency anaemia. Clin Chem Lab Med 2020;58:232-9.
29. Cubiella J, Digby J, Rodríguez-Alonso L, et al. The fecal hemoglobin concentration, age and sex test score: Development and external validation of a simple prediction tool for colorectal cancer detection in symptomatic patients. Int J Cancer 2017;140:2201-11.
30. Digby J, Strachan JA, Mowat C, et al. Appraisal of the faecal haemoglobin, age and sex test (FAST) score in assessment of patients with lower bowel symptoms: an observational study. BMC Gastroenterol 2019;19:213.
31. Fernández-Bañares F, Clèries R, Boadas J, et al. Prediction of advanced colonic neoplasm in symptomatic patients: a scoring system to prioritize colonoscopy (COLONOFIT study). BMC Cancer 2019;19:734.
32. Digby J, Steele RJ, Strachan JA, et al. Do other variables add value to assessment of the risk of colorectal disease using faecal immunochemical tests for haemoglobin? Ann Clin Biochem 2019;56:472-9.
33. Turvill J, Mellen S, Jeffery L, et al. Diagnostic accuracy of one or two faecal haemoglobin and calprotectin measurements in patients with suspected colorectal cancer. Scand J Gastroenterol 2018;53:1526-34.
34. Strachan JA, Mowat C. The use of faecal haemoglobin in deciding which patients presenting to primary care require further investigation (and how quickly) - the FIT approach. EJIFCC 2021;32:52-60.
35. Mowat C, Digby J, Strachan JA, et al. Faecal haemoglobin and faecal calprotectin as indicators of bowel disease in patients presenting to primary care with bowel symptoms. Gut 2016;65:1463-9.
36. Juul JS, Hornung N, Andersen B, et al. The value of using the faecal immunochemical test in general practice on patients presenting with non-alarm symptoms of colorectal cancer. Br J Cancer 2018;119:471-9.
37. Chapman C, Thomas C, Morling J, et al. Early clinical outcomes of a rapid colorectal cancer diagnosis pathway using faecal immunochemical testing in Nottingham. Colorectal Dis 2020;22:679-88.
2. Denis B, Guittet L. Dépistage du cancer colorectal par test immunologique quantitatif de recherche de sang occulte dans les selles : une révolution ? Hepato Gastro 2015;22:119-29.
3. HAu_te Autorité de santé. Endoscopie digestive basse : indications en dehors du dépistage en population. Recommandations pour la pratique clinique, HAS 2004. https://bit.ly/3blm5ES
4. NICE 2015. Suspected cancer: recognition and referral. NICE guideline [NG12]. https://www.nice.org.uk/guidance/ng12
5. NICE 2017. Quantitative faecal immunochemical tests to guide referral for colorectal cancer in primary care. Diagnostics guidance [DG30]. https://www.nice.org.uk/guidance/dg30
6. Scottish Governement. Clinical guidance on the use of faecal immunochemical testing (FIT) in the prioritisation of patients with colorectal symptoms. https://bit.ly/3f5fSOi
7. Denis B. Sang fécal occulte : quelle frontière entre physiologique et pathologique ? Hepato Gastro 2015;22:113-17.
8. Brenner H, Haug U, Hundt S. Inter-test agreement and quantitative cross-validation of immunochromatographical fecal occult blood tests. Int J Cancer 2010;127:1643-9.
9. Högberg C, Gunnarsson U, Jansson S, et al. Diagnosing colorectal cancer in primary care: cohort study in Sweden of qualitative faecal immunochemical tests, haemoglobin levels, and platelet counts. Br J Gen Pract 2020;70:e843-e851.
10. Daly JM, Xu Y, Levy BT. Which fecal immunochemical test should I choose? J Prim Care Community Health 2017;8:264-77.
11. Fraser CG, Benton SC. Detection capability of quantitative faecal immunochemical tests for haemoglobin (FIT) and reporting of low faecal haemoglobin concentrations. Clin Chem Lab Med 2019;57:611-6.
12. Imperiale TF, Gruber RN, Stump TE, et al. Performance Characteristics of Fecal Immunochemical Tests for Colorectal Cancer and Advanced Adenomatous Polyps: A Systematic Review and Meta-analysis. Ann Intern Med 2019;170:319-29.
13. Astin M, Griffin T, Neal RD, et al. The diagnostic value of symptoms for colorectal cancer in primary care: a systematic review. Br J Gen Pract 2011;61:e231-43.
14. Shapley M, Mansell G, Jordan JL, et al. Positive predictive values of ≥5% in primary care for cancer: systematic review. Br J Gen Pract 2010;60:e366-77.
15. Jellema P, van der Windt DA, Bruinvels DJ, et al. Value of symptoms and additional diagnostic tests for colorectal cancer in primary care: systematic review and meta-analysis. BMJ 2010;340:c1269.
16. Williams TG, Cubiella J, Griffin SJ, et al. Risk prediction models for colorectal cancer in people with symptoms: a systematic review. BMC Gastroenterol 2016;16:63.
17. Rodríguez-Alonso L, Rodríguez-Moranta F, Ruiz-Cerulla A, et al. An urgent referral strategy for symptomatic patients with suspected colorectal cancer based on a quantitative immunochemical faecal occult blood test. Dig Liver Dis 2015;47:797-804.
18. Herrero JM, Vega P, Salve M, et al. Symptom or faecal immunochemical test based referral criteria for colorectal cancer detection in symptomatic patients: a diagnostic tests study. BMC Gastroenterol 2018;18:155.
19. Westwood M, Lang S, Armstrong N, et al. Faecal immunochemical tests (FIT) can help to rule out colorectal cancer in patients presenting in primary care with lower abdominal symptoms: a systematic review conducted to inform new NICE DG30 diagnostic guidance. BMC Med 2017;15:189.
20. Pin Vieito N, Zarraquiños S, Cubiella J. High-risk symptoms and quantitative faecal immunochemical test accuracy: Systematic review and meta-analysis. World J Gastroenterol 2019;25:2383-401.
21. Burr NE, Derbyshire E, Taylor J, et al. Variation in post-colonoscopy colorectal cancer across colonoscopy providers in English National Health Service: population based cohort study. BMJ 2019;367:l6090.
22. D’Souza N, Georgiou Delisle T, Chen M, et al. Faecal immunochemical test is superior to symptoms in predicting pathology in patients with suspected colorectal cancer symptoms referred on a 2WW pathway: a diagnostic accuracy study. Gut 2020 Oct 21:gutjnl-2020-321956. Epub ahead of print.
23. McSorley ST, Digby J, Clyde D, et al. Yield of colorectal cancer at colonoscopy according to faecal haemoglobin concentration in symptomatic patients referred from primary care. Colorectal Dis 2020 Oct 16.
24. Mowat C, Digby J, Strachan JA, et al. Faecal haemoglobin concentration thresholds for reassurance and urgent investigation for colorectal cancer based on a faecal immunochemical test in symptomatic patients in primary care. Ann Clin Biochem 2021 Jan 21:4563220985547.
25. Benton SC, Fraser CG. Faecal immunochemical tests in the COVID-19 pandemic; safety-netting of patients with symptoms and low faecal haemoglobin concentration - can a repeat test be used? Ann Clin Biochem 2020 Oct 27:4563220967569. Epub ahead of print.
26. Digby J, Strachan JA, McCann R, et al. Measurement of faecal haemoglobin with a faecal immunochemical test can assist in defining which patients attending primary care with rectal bleeding require urgent referral. Ann Clin Biochem 2020;57:325-7.
27. Hicks G, D'Souza N, Georgiou Delisle T, et al. Using the faecal immunochemical test in patients with rectal bleeding: evidence from the NICE FIT study. Colorectal Dis 2021 Feb 19. .
28. Rodriguez-Alonso L, Rodriguez-Moranta F, Ruiz-Cerulla A, et al. The use of faecal immunochemical testing in the decision-making process for the endoscopic investigation of iron deficiency anaemia. Clin Chem Lab Med 2020;58:232-9.
29. Cubiella J, Digby J, Rodríguez-Alonso L, et al. The fecal hemoglobin concentration, age and sex test score: Development and external validation of a simple prediction tool for colorectal cancer detection in symptomatic patients. Int J Cancer 2017;140:2201-11.
30. Digby J, Strachan JA, Mowat C, et al. Appraisal of the faecal haemoglobin, age and sex test (FAST) score in assessment of patients with lower bowel symptoms: an observational study. BMC Gastroenterol 2019;19:213.
31. Fernández-Bañares F, Clèries R, Boadas J, et al. Prediction of advanced colonic neoplasm in symptomatic patients: a scoring system to prioritize colonoscopy (COLONOFIT study). BMC Cancer 2019;19:734.
32. Digby J, Steele RJ, Strachan JA, et al. Do other variables add value to assessment of the risk of colorectal disease using faecal immunochemical tests for haemoglobin? Ann Clin Biochem 2019;56:472-9.
33. Turvill J, Mellen S, Jeffery L, et al. Diagnostic accuracy of one or two faecal haemoglobin and calprotectin measurements in patients with suspected colorectal cancer. Scand J Gastroenterol 2018;53:1526-34.
34. Strachan JA, Mowat C. The use of faecal haemoglobin in deciding which patients presenting to primary care require further investigation (and how quickly) - the FIT approach. EJIFCC 2021;32:52-60.
35. Mowat C, Digby J, Strachan JA, et al. Faecal haemoglobin and faecal calprotectin as indicators of bowel disease in patients presenting to primary care with bowel symptoms. Gut 2016;65:1463-9.
36. Juul JS, Hornung N, Andersen B, et al. The value of using the faecal immunochemical test in general practice on patients presenting with non-alarm symptoms of colorectal cancer. Br J Cancer 2018;119:471-9.
37. Chapman C, Thomas C, Morling J, et al. Early clinical outcomes of a rapid colorectal cancer diagnosis pathway using faecal immunochemical testing in Nottingham. Colorectal Dis 2020;22:679-88.
Dans cet article
- Quels patients, quels symptômes sont concernés ?
- Hémoglobine fécale : les fondamentaux
- Tests qualitatifs
- Tests quantitatifs
- Rendement de la coloscopie en cas de symptômes
- Scores symptomatiques
- Utilisation diagnostique des tests immuno-chimiques quantitatifs
- Scores mixtes associant THF et facteurs cliniques
- Situation actuelle et perspectives en France
- Quatre propositions
- Recherche
- Conclusion