La fibrillation atriale (FA) est le trouble du rythme cardiaque le plus fréquent en France et dans le monde. Quarante-six millions de personnes sont atteintes de FA sur la planète et sa prévalence ne cesse d’augmenter, puisqu’elle a été multipliée par 3 au cours des 50 dernières années.1 La FA est associée à un risque 1,5 à 2 fois plus important de mortalité toutes causes. Elle multiplie par 2 à 3 le risque d’accident vasculaire cérébral (AVC), de 2 à 3 fois et par 5 le risque d’insuffisance cardiaque.2 De plus, son impact financier sur les systèmes de santé est particulièrement lourd. En 2012, les coûts liés à la FA en France étaient estimés à presque 2 milliards d’euros, soit 2,6 % des dépenses du système de santé français. Ces coûts étaient liés en majeure partie aux hospitalisations.3
Ces dernières années, les dispositifs permettant de dépister la FA se sont énormément développés. Dans cet article, nous allons détailler quels sont les moyens de dépistage de la FA en 2020 mais également quelles en sont les limites.
Pourquoi dépister ?
En plus d’être une maladie fréquente, la FA est asymptomatique chez 15 à 30 % des patients.4, 5 Malgré l’absence de symptômes, ces patients ont le même risque thromboembolique que les patients symptomatiques, et environ 70 % des patients en fibrillation asymptomatique ont une indication à l’anticoagulation. De plus, 5 % des patients ont un AVC comme première manifestation de leur fibrillation.6 Dépister la FA est donc primordial pour traiter cette maladie et éviter les complications.
Que disent les recommandations ?
Le dépistage de la FA présente plusieurs avantages potentiels, notamment l’identification des patients avec des fibrillations asymptomatiques qui pourraient bénéficier d’un traitement anticoagulant pour prévenir les AVC, ou d’un traitement antiarythmique pour diminuer les symptômes.
Les recommandations de la Société européenne de cardiologie de 2020 (
Outils de dépistage
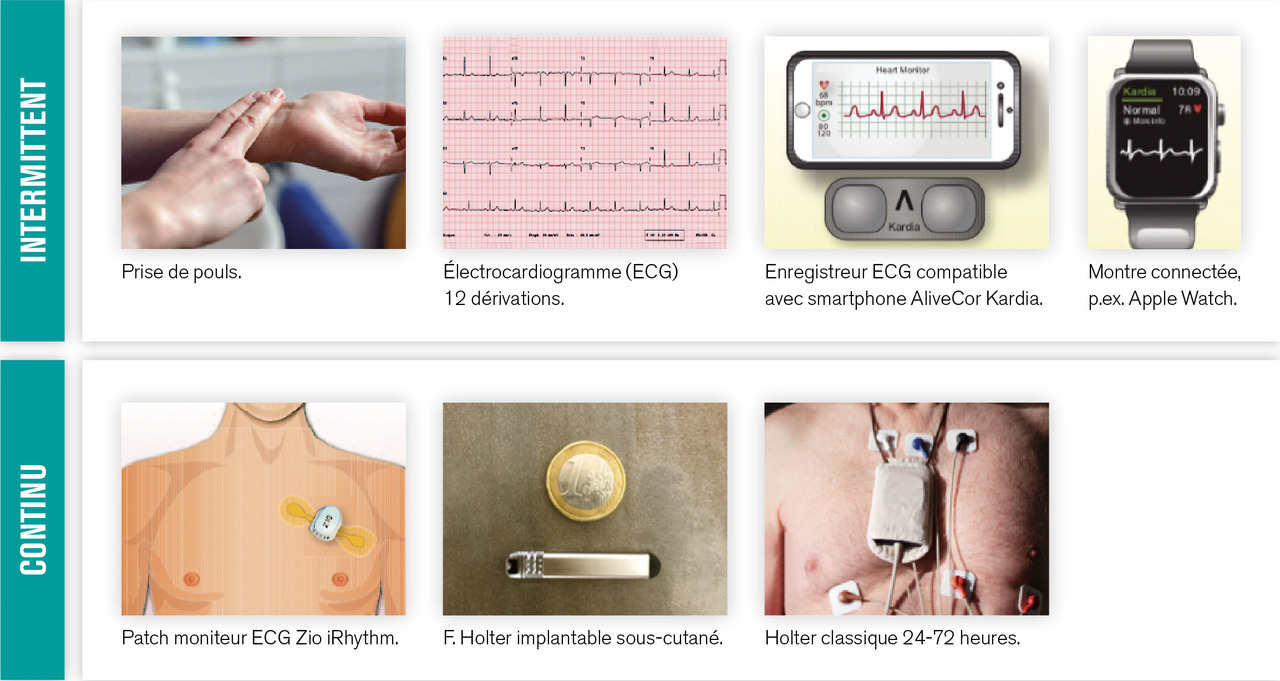
Dépister le plus précocement possible la FA est toujours un véritable défi pour les médecins, et de nouvelles méthodes diagnostiques pourraient rendre cette tâche plus facile. Il existe de nombreux outils de dépistage (tableau 2), allant de méthodes intermittentes peu coûteuses, moins sensibles et moins spécifiques à des méthodes continues plus coûteuses qui peuvent enregistrer des données électrocardiographiques pendant des semaines, voire des années (
Les modalités traditionnelles du dépistage comprennent la palpation manuelle du pouls et l’ECG 12 dérivations. De plus, les derniers tensiomètres disponibles sur le marché permettent également de détecter un pouls irrégulier.
Appareils portatifs enregistreurs d’ECG compatibles avec un smartphone
Ces appareils portables sont utilisés pour saisir un enregistrement électrocardiographique qui peut être stocké sur l’appareil ou téléchargé sur un smartphone. Le contrôle par le patient permet ainsi d’effectuer des enregistrements à domicile, notamment lors des symptômes. La plupart des appareils permettent de transférer électroniquement les tracés pour être examinés par un professionnel de santé.
Les dispositifs les plus récents comprennent des technologies portatives, y compris un smartphone couplé à un support (AliveCor Kardia) permettant de faire un ECG 1 dérivation correspondant à la dérivation D1. Plus récemment, une nouvelle version permet de réaliser un ECG 6 dérivations (I, II, III, aVR, aVL, aVF).8 De plus, ce dispositif a récemment été validé pour mesurer l’intervalle QT. Les autres appareils disponibles sont, par exemple, Zenicor-ECG (Zenicor) ou MyDiagnostick (Applied Biomedical Systems [ABV]). Tous ces dispositifs ne sont pas remboursés en France.
Montres connectées
Les montres connectées, comme Apple Watch, peuvent également détecter l’arythmie par une méthode de photopléthysmographie. Cette méthode est fondée sur la détection du flux sanguin pour créer un tachogramme. Un algorithme analyse ces informations pour détecter la FA. Ce système offre une surveillance prolongée à domicile.9 La dernière version fonctionne comme AliveCor Kardia, directement par l’acquisition du signal (entre le pouce controlatéral posé sur bracelet et l’électrode au dos de la montre collée sur le poignet homolatéral) et non par photopléthysmographie. Ces dispositifs ne sont pas remboursés en France. Néanmoins, les tracés électrocardiographiques à une seule dérivation doivent dans certains cas être confirmés par un ECG traditionnel à 12 dérivations pour garantir un diagnostic correct de la fibrillation. Des délais importants entre un diagnostic préliminaire de FA et un test de confirmation peuvent donc réduire l’efficacité d’une intervention de dépistage.
Patchs moniteurs ECG
Les patchs adhésifs permettent de surveiller le rythme en continu jusqu’à 2 semaines. Ce système a l’avantage d’offrir une surveillance sur une période prolongée, continue et de manière non invasive. Ils peuvent être appliqués par les patients eux-mêmes et sont bien tolérés. Les systèmes actuellement disponibles sont Zio (iRhythm), CardioStat (Icentia), et Nuvant (Corventis). Ces dispositifs ne sont pas remboursés en France.
Holter implantable
Le Holter implantable est un dispositif de moins de 2 cm3 qui est inséré sous la peau en regard du sternum. Il devrait stricto sensu s’appeler moniteur cardiaque implantable car il ne va enregistrer que des événements préspécifiés, et ne permet pas un enregistrement continu comme le Holter-ECG traditionnel. Il peut monitorer le rythme cardiaque pour une durée allant jusqu’à 4 ans. Il est actuellement remboursé dans deux indications : syncopes inexpliquées ou AVC cryptogénique. Lorsqu’il est couplé à un système de télécardiologie, le médecin peut consulter régulièrement le rythme cardiaque du patient. Plusieurs modèles existent : Medtronic Linq, Biotronik Biomonitor3 et Abbott Confirm Rx.
Limites du dépistage
Jusqu’alors, les essais randomisés de dépistage de la FA n’ont pas démontré une réduction des AVC, mais on peut leur reprocher un manque de puissance. De nombreuses études sont en cours et permettront de savoir si cette stratégie est réellement pertinente.
Les avantages potentiels du dépistage et du traitement précoce de la FA doivent donc être mis en balance avec les inconvénients potentiels, comme le risque hémorragique lié à l’initiation d’un traitement anticoagulant. De plus, des tests de dépistage appliqués au niveau de la population générale entraîneront des diagnostics faussement positifs, à l’origine d’une utilisation d’anticoagulants en dehors de toute indication. Un autre inconvénient est que le dépistage de manière prolongée par des outils de surveillance continue de la FA augmente la probabilité de détecter de courts épisodes de fibrillation, dont la signification clinique peut être incertaine. En effet, il y a de plus en plus de preuves que la charge (pourcentage de temps passé en fibrillation sur 24 heures) de la FA est liée au risque d’AVC. Il n’est pas certain que des épisodes très peu fréquents et courts de fibrillation, détectés uniquement par un dépistage continu, augmentent suffisamment le risque d’AVC pour accepter les risques d’un traitement anticoagulant au long cours.11 Enfin, tous les outils de dépistage ne sont pas suffisants pour établir un diagnostic de FA. Par exemple, certaines formes de détection du rythme peuvent fréquemment conduire à des résultats indéterminés, tandis que d’autres nécessitent un ECG de confirmation, ce qui contribue à l’anxiété du patient et à l’augmentation des coûts.
Le futur du dépistage de la FA
De façon plus anecdotique pour le moment, des méthodes de dépistage sans contact sont en développement. Une étude récente a utilisé l’analyse des signaux photopléthysmographiques du visage, sans contact physique, en utilisant une caméra de smartphone.10 Cela permettrait un dépistage massif de la FA, avec cependant toutes les limites énoncées ci-dessus.
Questions non résolues
Pour conclure, il est recommandé de dépister la FA chez les patients de plus de 65 ans. Le dépistage peut avoir lieu par la prise de pouls ou la réalisation d’un ECG, mais de nombreux outils connectés particulièrement intéressants sont apparus qui permettent d’en augmenter la sensibilité.
Mais comment doit-on considérer la FA infraclinique ? Qui doit-on traiter ? Il faut identifier un sous-groupe de patients suffisamment à risque pour amortir les risques liés à un traitement anticoagulant au long cours. Le dépistage de la FA comporte encore de nombreuses limites.
1. Kornej J, Börschel CS, Benjamin EJ, Schnabel RB. Epidemiology of atrial fibrillation in the 21st Century. Circ Res 2020;127:4-20.
2. Odutayo A, Wong CX, Hsiao AJ, Hopewell S, Altman DG, Emdin CA. Atrial fibrillation and risks of cardiovascular disease, renal disease, and death: systematic review and meta-analysis. BMJ 2016;354:i4482.
3. Cotté FE, Chaize G, Gaudin AF, Samson A, Vainchtock A, Fauchier L. Burden of stroke and other cardiovascular complications in patients with atrial fibrillation hospitalized in France. Europace 2016;18:501-7.
4. Dilaveris PE, Kennedy HL. Silent atrial fibrillation: epidemiology, diagnosis, and clinical impact. Clin Cardiol 2017;40:413-8.
5. Turakhia MP, Blankestijn PJ, Carrero JJ, et al. Chronic kidney disease and arrhythmias: conclusions from a Kidney Disease: Improving Global Outcomes (KDIGO) Controversies Conference. Eur Heart J 2018;39:2314-25.
6. Lubitz SA, Yin X, McManus DD, et al. Stroke as the Initial Manifestation of Atrial Fibrillation: The Framingham Heart Study. Stroke 2017;48:490-2.
7. Hindricks G, Potpara T, Dagres N, Aet al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association of Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2020. Epub ahead of print. PMID: 32860505.
8. Halcox JPJ, Wareham K, Cardew A, et al. Assessment of remote heart rhythm sampling using the AliveCor heart monitor to screen for atrial fibrillation: the REHEARSE-AF study. Circulation 2017;136:1784-94.
9. Perez MV, Mahaffey KW, Hedlin H, et al. Large-scale assessment of a smartwatch to identify atrial fibrillation. N Engl J Med 2019;381:1909-17.
10. Yan BP, Lai WHS, Chan CKY, et al. High-throughput, contact-free detection of atrial fibrillation from video with deep learning. JAMA Cardiol 2020;5:105-7.
11. Bertaglia E, Blank B, Blomström-Lundqvist C, et al. Atrial high-rate episodes: prevalence, stroke risk, implications for management, and clinical gaps in evidence. Europace 2019;21:1459-67.