Critères diagnostiques du syndrome de Gilles de la Tourette selon le DSM- 5
Âmes curieuses, ne pas s’abstenir !
- En savoir plus sur Âmes curieuses, ne pas s’abstenir !
- Se connecter ou s'inscrire pour poster un commentaire
Sur un air de Florent Pagny : « Savoir dire non... »
- En savoir plus sur Sur un air de Florent Pagny : « Savoir dire non... »
- Se connecter ou s'inscrire pour poster un commentaire
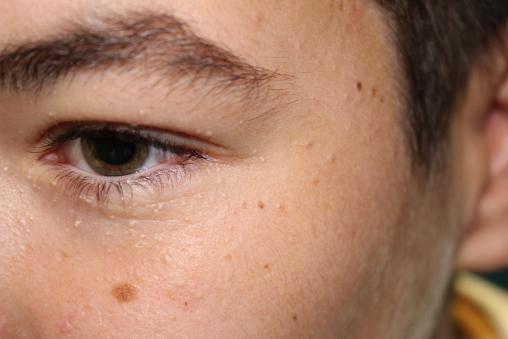
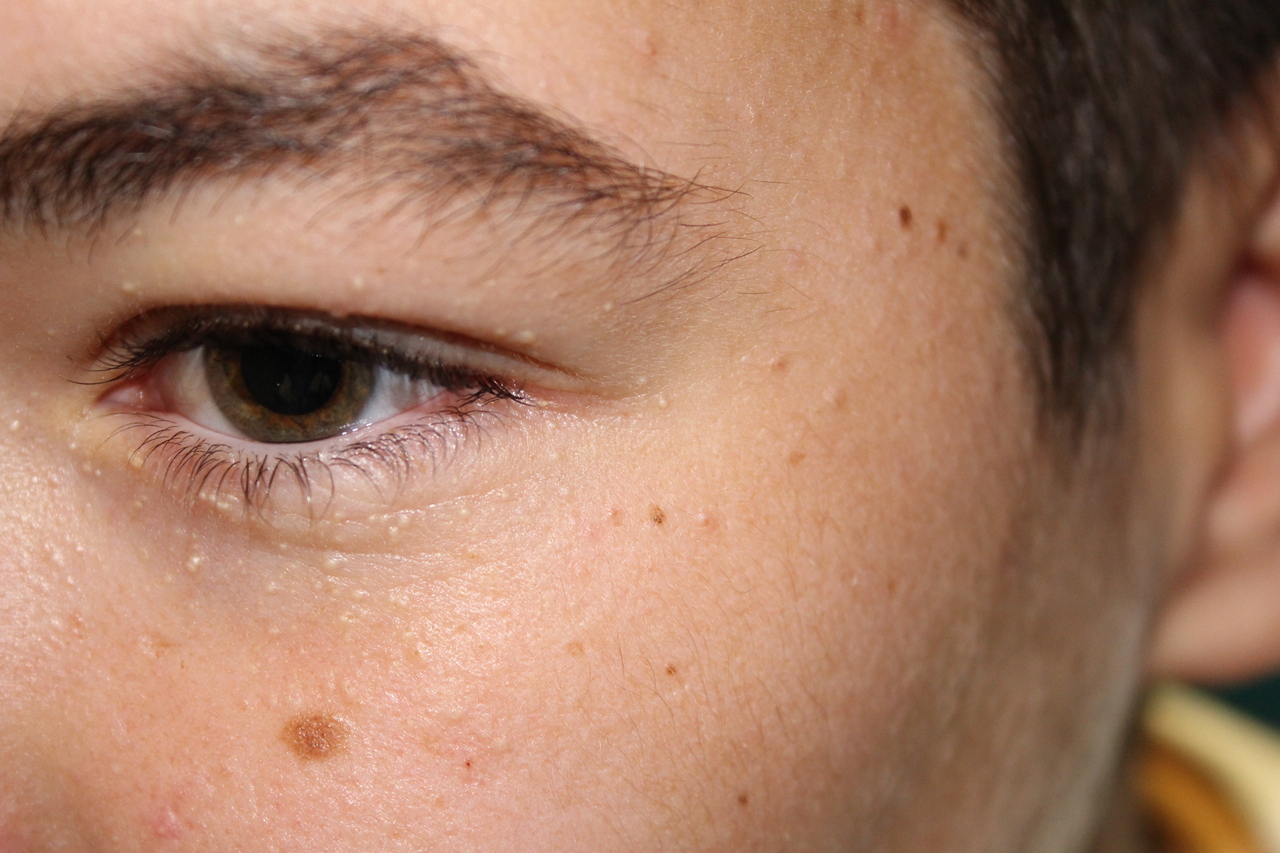
Grains de milium
Baptiste, 16 ans, consulte pour des tuméfactions blanches de petite taille (moins de 0,5 cm) localisées sur le pourtour des yeux et apparues quelques mois auparavant (figure).
Pour en savoir plus
Saurat JH, Lipsker D, Thomas L, et al. Dermatologie et infections sexuellement transmissibles. Ed. Elsevier Masson 2017.
0
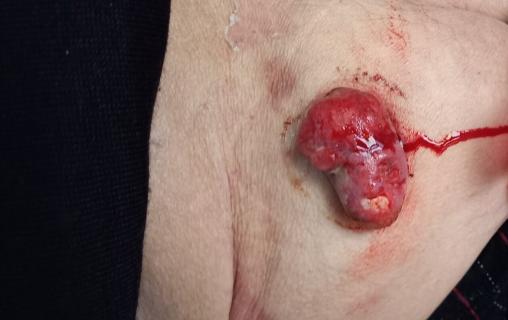
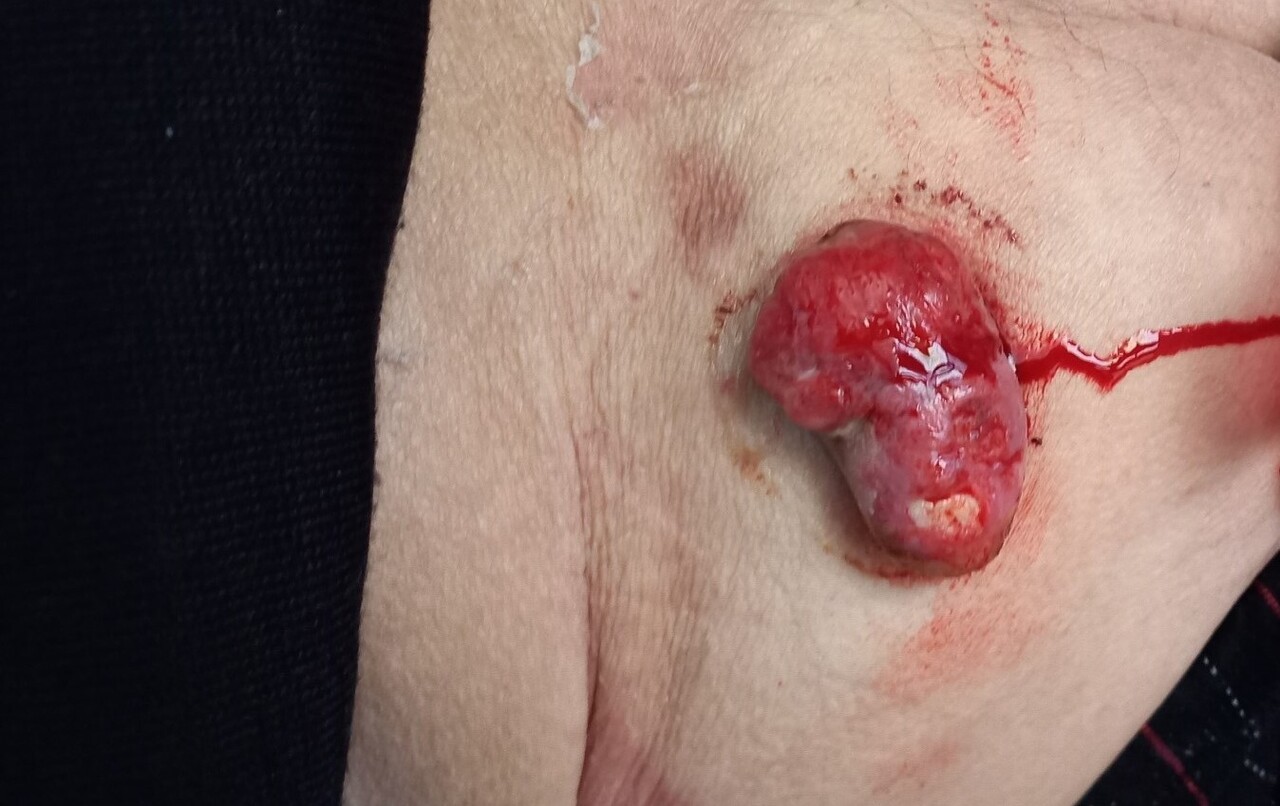
Léiomyosarcome cutané profond
Émile, 69 ans, diabétique, consulte pour une tuméfaction douloureuse et sanguinolente de grande taille au niveau de la partie supérieure de la cuisse (figure). Une exérèse est effectuée.
Pour en savoir plus
Wong GN, Webb A, Gyorki D, et al. Cutaneous leiomyosarcoma: dermal and subcutaneous. Australas J Dermatol 2020;61(3):243-9.
0
Ischémie médullaire
Un jeune homme de 17 ans, sans antécédent personnel ni familial, est admis au service des urgences pour un déficit moteur et sensitif des deux membres inférieurs, associé à une rétention aiguë d’urine.
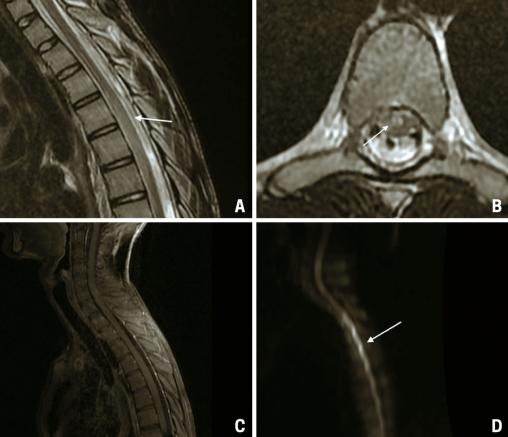
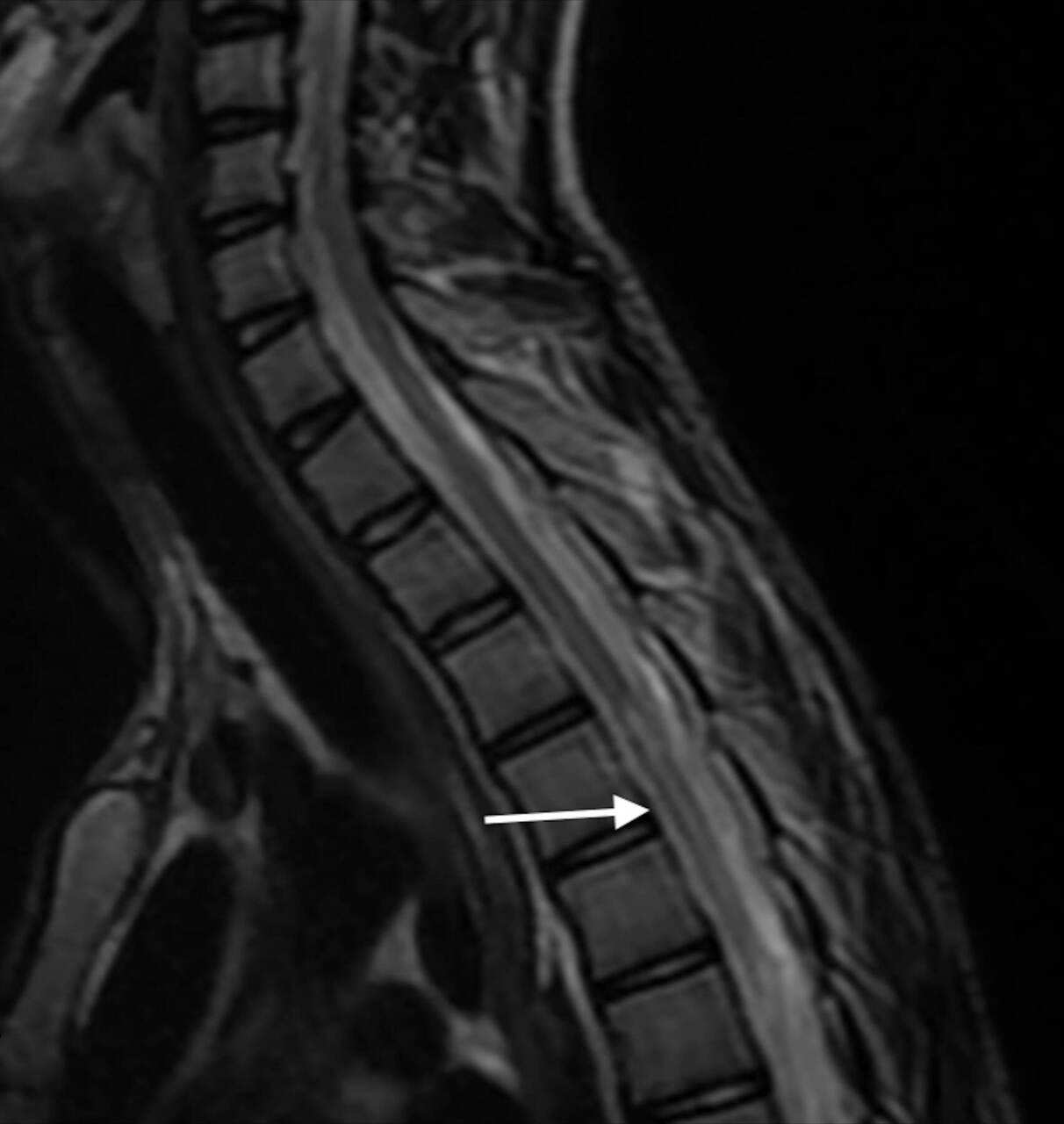
Une IRM médullaire est réalisée en urgence, mettant en évidence une anomalie de signal centromédullaire étendue de T4 à T6 en hypersignal T2 – réalisant un aspect en « œil de hibou » –, avec une restriction en diffusion et sans prise de contraste après injection de gadolinium (fig. 1).
Le bilan étiologique est complété par une IRM cérébro-orbitaire, à la recherche d’anomalies évocatrices de sclérose en plaques ou de neuromyélite optique, revenue sans anomalie. L’examen ophtalmologique est également normal, ainsi que l’analyse du liquide cérébrospinal.
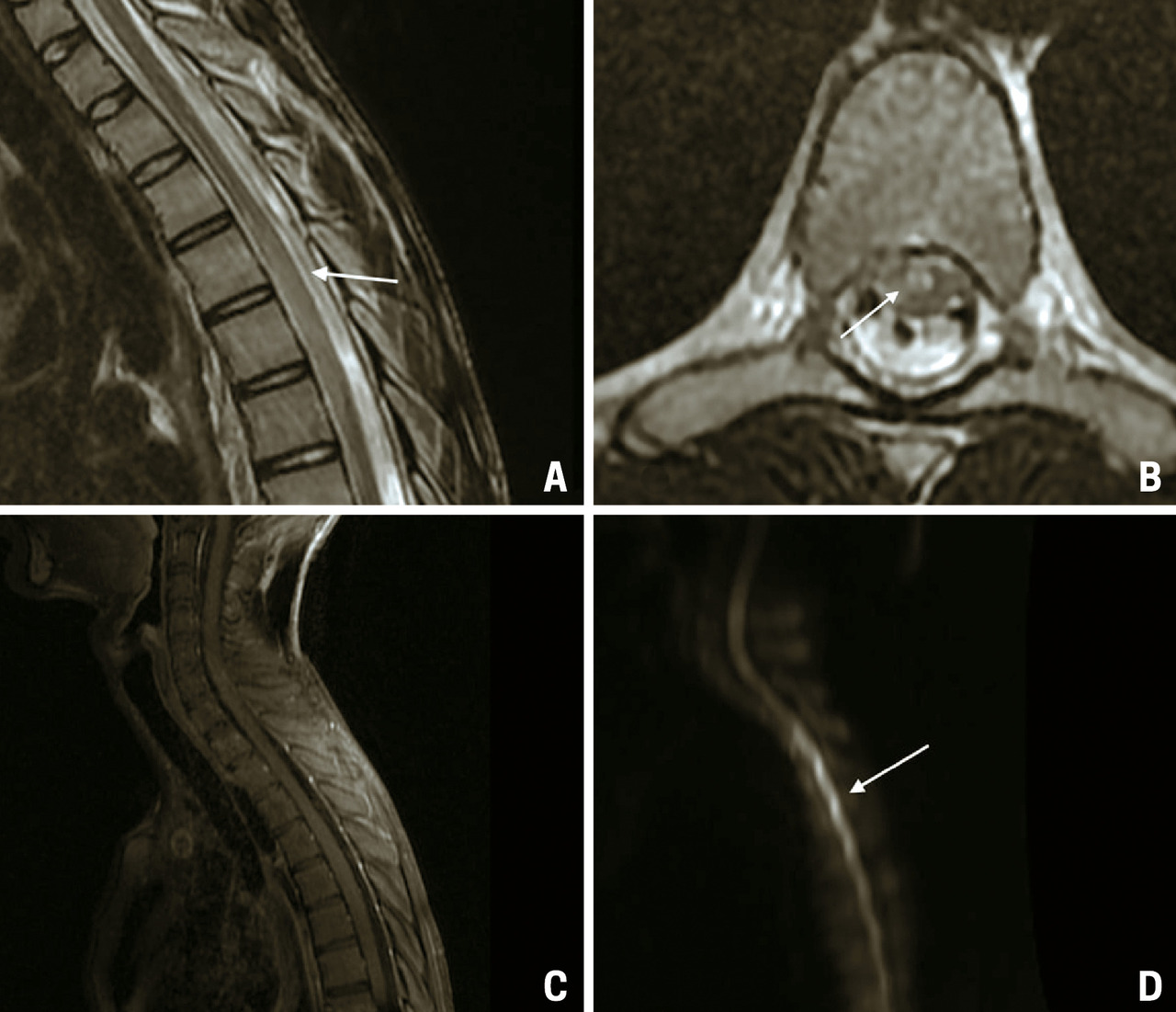
Une IRM de contrôle est réalisée à J20, montrant une évolution de la myélite vers une cavitation avec atrophie médullaire (fig. 2).
L’installation brutale du déficit, l’absence d’anomalies associées et l’aspect radiologique sur les IRM initiale et de contrôle permettent d’évoquer une origine ischémique de cette myélite du territoire spinal antérieur.
Une IRM médullaire est réalisée en urgence, mettant en évidence une anomalie de signal centromédullaire étendue de T4 à T6 en hypersignal T2 – réalisant un aspect en « œil de hibou » –, avec une restriction en diffusion et sans prise de contraste après injection de gadolinium (fig. 1).
Le bilan étiologique est complété par une IRM cérébro-orbitaire, à la recherche d’anomalies évocatrices de sclérose en plaques ou de neuromyélite optique, revenue sans anomalie. L’examen ophtalmologique est également normal, ainsi que l’analyse du liquide cérébrospinal.
Une IRM de contrôle est réalisée à J20, montrant une évolution de la myélite vers une cavitation avec atrophie médullaire (fig. 2).
L’installation brutale du déficit, l’absence d’anomalies associées et l’aspect radiologique sur les IRM initiale et de contrôle permettent d’évoquer une origine ischémique de cette myélite du territoire spinal antérieur.
Références
1.Weidauer S, Nichtweiß M, Hattingen E, et al. Spinal cord ischemia: aetiology, clinical syndromes and imaging features. Neuroradiology 2015;57:241–57.
2. AbdelRazek MA, Mowla A, Farooq S, et al. Fibrocartilaginous embolism: a comprehensive review of an under-studied cause of spinal cord infarction and proposed diagnostic criteria. J Spinal Cord Med 2016;39(2):146-54.
2. AbdelRazek MA, Mowla A, Farooq S, et al. Fibrocartilaginous embolism: a comprehensive review of an under-studied cause of spinal cord infarction and proposed diagnostic criteria. J Spinal Cord Med 2016;39(2):146-54.
0
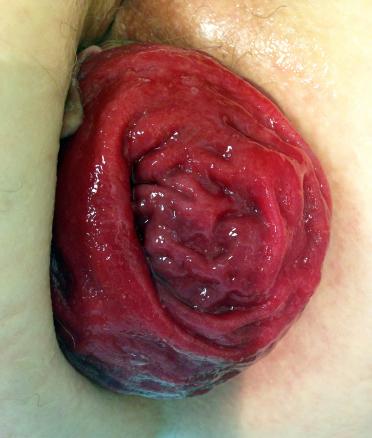
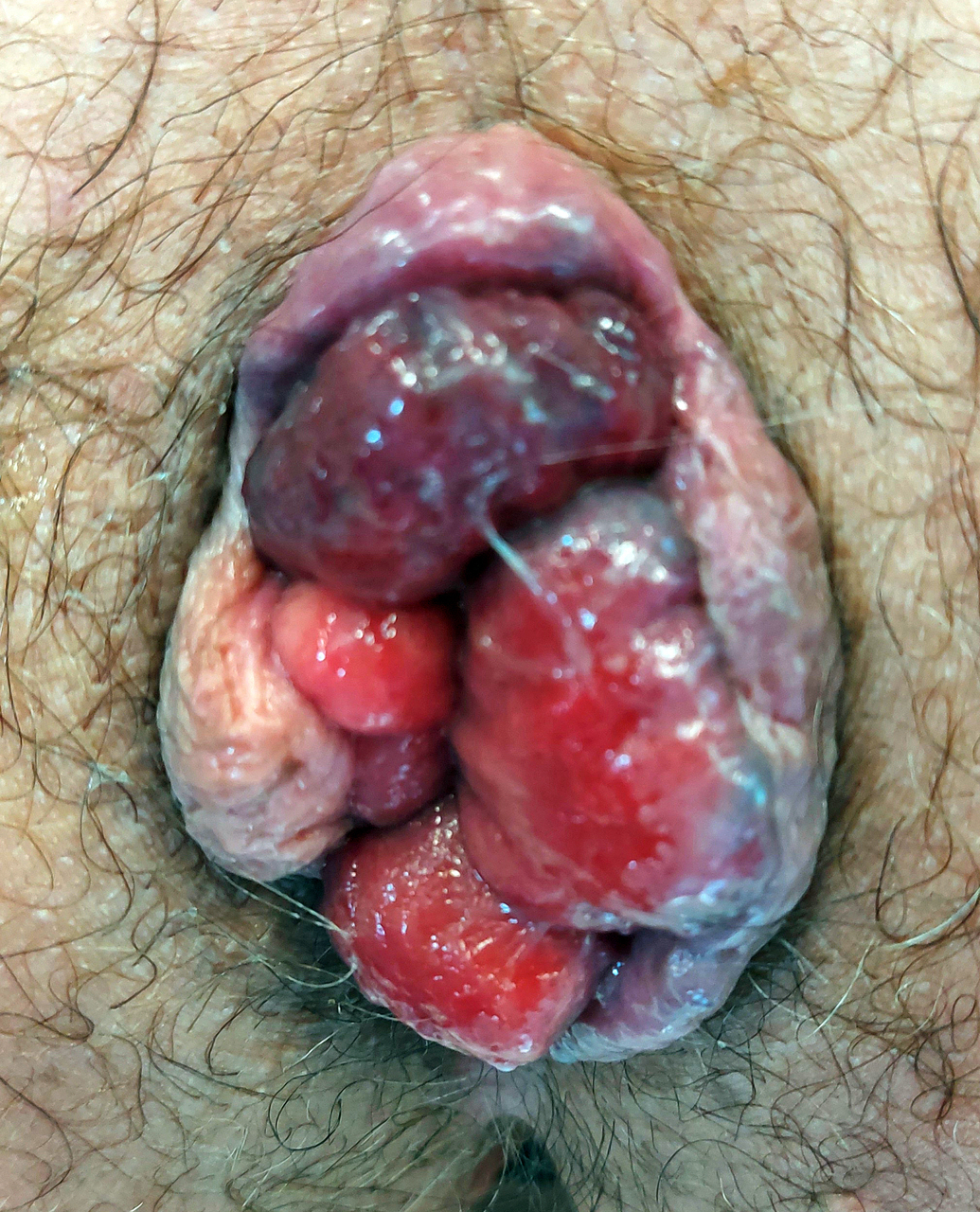
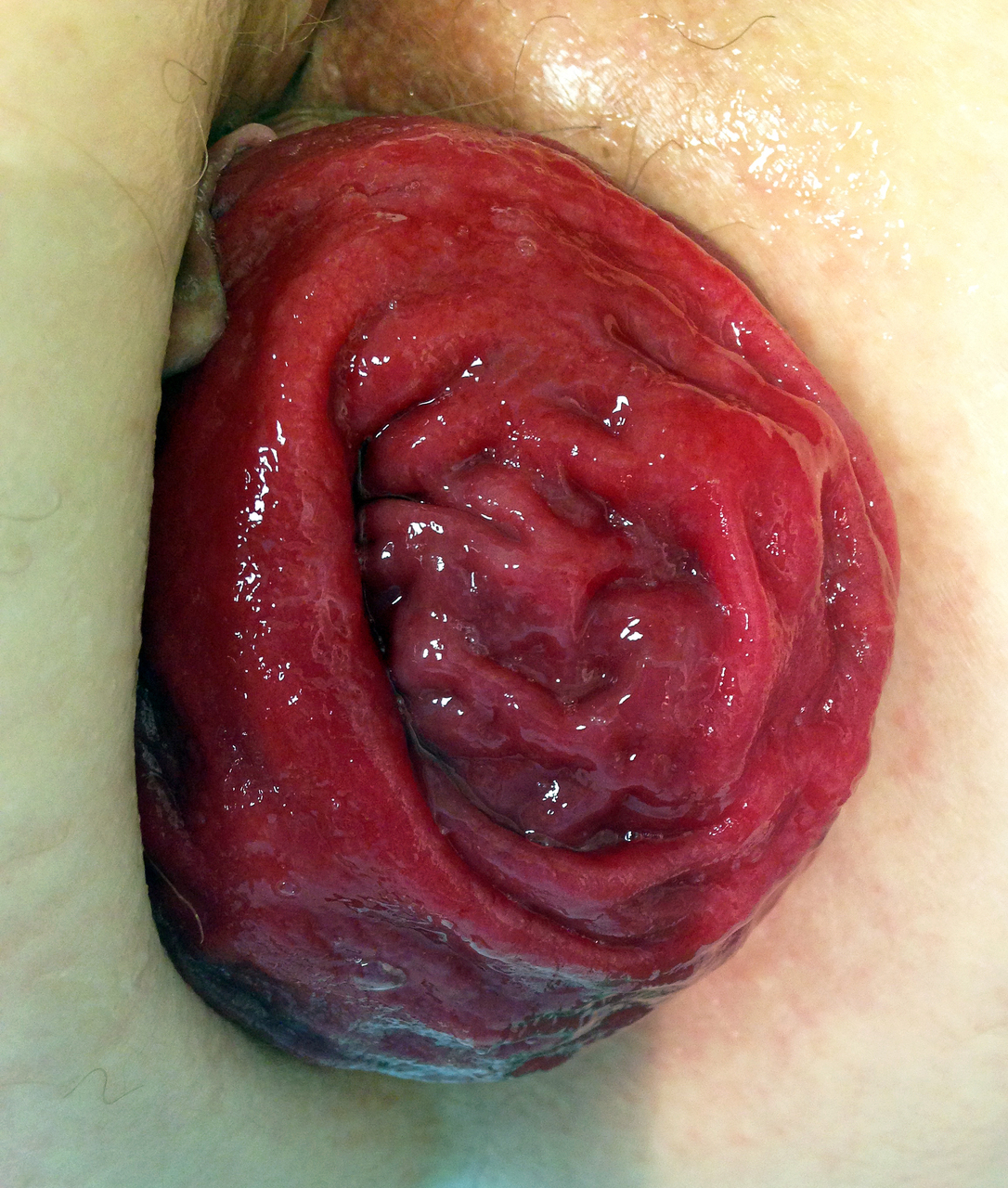
Prolapsus hémorroïdaire interne de grade IV
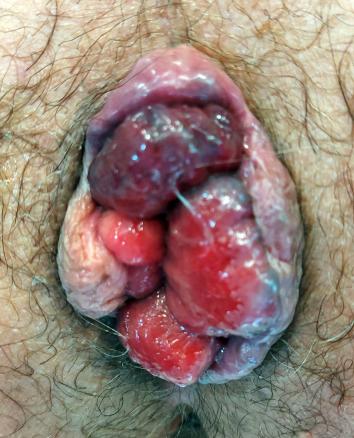
Un homme de 30 ans consulte pour un suintement anal tachant le linge depuis plusieurs mois. L’examen clinique révèle plusieurs tuméfactions, localisées au niveau de la marge anale, non douloureuses à la palpation (fig. 1).
Pour en savoir plus
Jakubauskas M, Poskus T. Evaluation and Management of Hemorrhoids. Dis Colon Rectum 2020;63:420-4.
Van Tol RR, Kleijnen J, Watson AJM, et al. European Society of ColoProctology: guideline for haemorrhoidal disease. Colorectal Dis 2020;22:650-2.
Van Tol RR, Kleijnen J, Watson AJM, et al. European Society of ColoProctology: guideline for haemorrhoidal disease. Colorectal Dis 2020;22:650-2.
0
Tics de l’enfant et syndrome de Gilles de la Tourette
- En savoir plus sur Tics de l’enfant et syndrome de Gilles de la Tourette
- Se connecter ou s'inscrire pour poster un commentaire