Une patiente de 50 ans se présente aux urgences pour des mouvements involontaires de l’hémicorps gauche apparus dix jours auparavant. L’anamnèse retrouve un diabète de type 2 sous insuline, avec une mauvaise observance thérapeutique et un épisode d’hyperglycémie vingt jours avant l’apparition des symptômes, sans antécédent d’autres troubles neurologiques, ni de vascularite, ni de déficit immunitaire, d’infection, ou de prise de toxique.
Les mouvements des groupements musculaires proximaux et distaux de l’hémicorps gauche sont de grande amplitude, complexes et multidirectionnels. Le tonus musculaire et les réflexes sont normaux, sans dysarthrie.
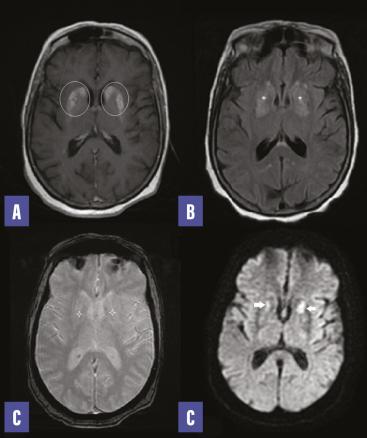
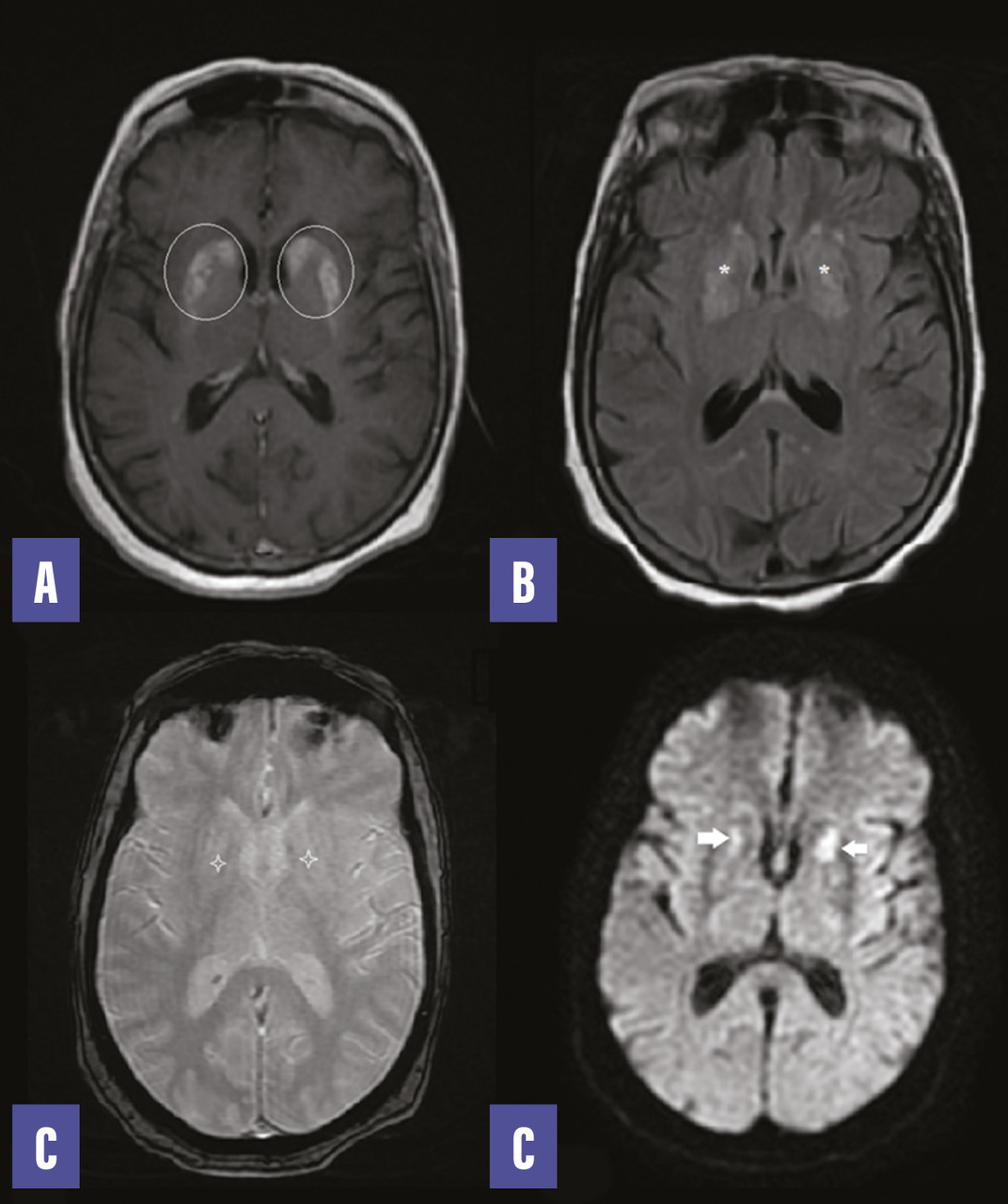
Le bilan biologique révèle une glycémie à 4,1 g/L, une HbA1C à 13 %, un taux de globules blancs à 5 000/mm3, une protéine C-réactive à 5 mg/L. L’ionogramme et la bandelette urinaire sont sans particularité. L’IRM encéphalique montre des anomalies (figure ). Devant cet aspect, le diagnostic d’une striatopathie diabétique est retenu. Un traitement par halopéridol n’a pas permis de nette amélioration des symptômes.
Les mouvements des groupements musculaires proximaux et distaux de l’hémicorps gauche sont de grande amplitude, complexes et multidirectionnels. Le tonus musculaire et les réflexes sont normaux, sans dysarthrie.
Le bilan biologique révèle une glycémie à 4,1 g/L, une HbA1C à 13 %, un taux de globules blancs à 5 000/mm3, une protéine C-réactive à 5 mg/L. L’ionogramme et la bandelette urinaire sont sans particularité. L’IRM encéphalique montre des anomalies (
La striatopathie diabétique, également appelée hémichorée-hémiballisme et hyperglycémie non cétosique, est une complication rare de l’hyperglycémie, plus fréquente chez les diabétiques de type 2. Le mécanisme physiopathologique exact n’est pas encore élucidé, mais deux hypothèses peuvent expliquer la contribution de l’hyperglycémie à l’hypoperfusion cérébrale, soit par altération des mécanismes d’autorégulation vasculaire cérébrale, soit par atteinte de la barrière hémato-encéphalique secondaire à une hyperviscosité sanguine.1
Le diagnostic est retenu devant un faisceau d’arguments cliniques, biologiques et radiologiques, sur un terrain de diabète de type 2, compliqué d’une hyperglycémie sans cétose ; le tableau clinique est constitué d’un hémiballisme et d’une hémichorée sans autre contexte neurologique ou toxique. L’imagerie retrouve typiquement une anomalie unilatérale de signal des noyaux gris centraux, en particulier du striatum (noyau caudé et putamen) dans 90 % des cas. Cependant, le signal en T2 et en diffusion peut varier selon le mécanisme d’atteinte ainsi que le caractère uni- ou bilatéral et la localisation de l’atteinte des noyaux de la base.1,2
Les autres causes de la chorée et du ballisme comprennent les maladies cérébrovasculaires, auto-immunes, toxiques, malignes et infectieuses.2
Le traitement consiste initialement à corriger l’hyperglycémie et l’hydratation. Si les signes cliniques persistent, un recours aux antipsychotiques est possible ; en dernier lieu, une pallidotomie postéro-ventrale peut être proposée dans les formes résistantes.2,3
L’évolution est le plus souvent favorable : résolution de la symptomatologie à quinze jours, qui précède la disparition des anomalies radiologiques (généralement après 2 mois pour le scanner et 6 mois pour l’IRM). Cependant, une récidive reste possible dans 20 % des cas.2,3
Le diagnostic est retenu devant un faisceau d’arguments cliniques, biologiques et radiologiques, sur un terrain de diabète de type 2, compliqué d’une hyperglycémie sans cétose ; le tableau clinique est constitué d’un hémiballisme et d’une hémichorée sans autre contexte neurologique ou toxique. L’imagerie retrouve typiquement une anomalie unilatérale de signal des noyaux gris centraux, en particulier du striatum (noyau caudé et putamen) dans 90 % des cas. Cependant, le signal en T2 et en diffusion peut varier selon le mécanisme d’atteinte ainsi que le caractère uni- ou bilatéral et la localisation de l’atteinte des noyaux de la base.1,2
Les autres causes de la chorée et du ballisme comprennent les maladies cérébrovasculaires, auto-immunes, toxiques, malignes et infectieuses.2
Le traitement consiste initialement à corriger l’hyperglycémie et l’hydratation. Si les signes cliniques persistent, un recours aux antipsychotiques est possible ; en dernier lieu, une pallidotomie postéro-ventrale peut être proposée dans les formes résistantes.2,3
L’évolution est le plus souvent favorable : résolution de la symptomatologie à quinze jours, qui précède la disparition des anomalies radiologiques (généralement après 2 mois pour le scanner et 6 mois pour l’IRM). Cependant, une récidive reste possible dans 20 % des cas.2,3
Références
1. Ginat DT, Meyers SP. Intracranial lesions with high signal intensity on T1-weighted MR images: differential diagnosis. Radiographics 2012;32(2):499-516.
2. Chua CB, Sun CK, Hsu CW, Tai YC, Liang CY, Tsai IT. “Diabetic striatopathy”: Clinical presentations, controversy, pathogenesis, treatments, and outcomes. Sci Rep 2020;10(1):1594.
3. Rocha Cabrero F, De Jesus O. Hemiballismus. In: StatPearls [internet]. Treasure Island (FL): StatPearls Publishing; 2023 Jan.
2. Chua CB, Sun CK, Hsu CW, Tai YC, Liang CY, Tsai IT. “Diabetic striatopathy”: Clinical presentations, controversy, pathogenesis, treatments, and outcomes. Sci Rep 2020;10(1):1594.
3. Rocha Cabrero F, De Jesus O. Hemiballismus. In: StatPearls [internet]. Treasure Island (FL): StatPearls Publishing; 2023 Jan.
Une question, un commentaire ?